题目内容
15.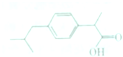 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |
分析 有机物含有羧基,具有酸性,可发生中和、酯化反应,以此解答该题.
解答 解:A.由结构简式可知有机物分子式为C13H18O2,故A错误;
B.布洛芬与苯甲酸结构相似,都含有苯环和羧基,分子式不同,属于同系物,故B正确;
C.含有羧基,可发生取代反应,苯环能发生加成反应,故C正确;
D.丁基有-CH2CH2CH2CH3、-CH2CH(CH3)2、-CH(CH3)CH2CH3,丙酸基-CH(CH3)COOH、-CH2CH2COOH2种,且两个基团有邻、间、对3种,共12种,故D正确.
故选A.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,注意有机物的含有的官能团的性质,此为解答该题的关键,注意把握同分异构体的判断.

练习册系列答案
相关题目
5. 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量:
请回答下列问题:
(1)如图表示某反应的能量变化关系图,若此能量变化关系 图表示反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)
△H=-241..8kJ•mol-1,则B=926kJ•mol-1,x=496.4.
 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量:| 化学键 | H-H | Cl-Cl | I-I | O═O | C-Cl | C-H | O-H | H-Cl | H-I |
| 断裂1mol化学键所吸收的能量(kJ) | 436 | 247 | 151 | x | 330 | 413 | 463 | 431 | 299 |
(1)如图表示某反应的能量变化关系图,若此能量变化关系 图表示反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)
△H=-241..8kJ•mol-1,则B=926kJ•mol-1,x=496.4.
6.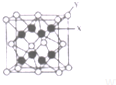 A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
回答下列问题
(用元素符号表示):
(1)C元素基态原子的价电子排布图为
(2)[E(A2C)4]2+中E2+与A2C间的作用为B(填字母编号
A.离子键 B.配位键 C.金属键 D.分子间作用力
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则X应为K+
D2C的熔点比CaF2的熔点低(填“高”、“低”、“无法比较”)
(4)与B2C互为等电子体分子为CO2,其分子的立体构型为直线型
(5)已知:A2(g)+$\frac{1}{2}$C2(g)=A2C(g)△H1=-akJ/mol
B2(g)+3A2(g)=2BA3(g)△H2=-bkJ/mol
则34gBA3(g)与C2(g)反应生成B2(g)与A2C(g)时,该反应的热化学反应方程式为2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
 A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:回答下列问题
| 元素 | 相关信息 |
| A | 元素A是周期表中原子半径最小的元素 |
| B | B的单质由双原子分子构成,分子中有14个电子 |
| C | C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌 |
| D | D是前四周期元素中第一电离能最小的元素 |
| E | E位于ds区且原子的最外层电子数与A相同 |
(1)C元素基态原子的价电子排布图为

(2)[E(A2C)4]2+中E2+与A2C间的作用为B(填字母编号
A.离子键 B.配位键 C.金属键 D.分子间作用力
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则X应为K+
D2C的熔点比CaF2的熔点低(填“高”、“低”、“无法比较”)
(4)与B2C互为等电子体分子为CO2,其分子的立体构型为直线型
(5)已知:A2(g)+$\frac{1}{2}$C2(g)=A2C(g)△H1=-akJ/mol
B2(g)+3A2(g)=2BA3(g)△H2=-bkJ/mol
则34gBA3(g)与C2(g)反应生成B2(g)与A2C(g)时,该反应的热化学反应方程式为2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
3.用括号中的试剂除去各组物质中的少量杂质正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
10.某探究小组用如图所示装置进行如下实验,其实验现象描述正确的是( )
| 选项 | a中试剂 | b中试剂 | 实验现象 | 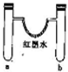 |
| A | 1mL12mol•L-1浓盐酸0.5gMnO2 | 0.1gCaCO3、1mL 2mol•L-1盐酸 | 红墨水褪色,U形管中液面左右基本持平 | |
| B | 0.1gNa3mol水 | 0.1gNa 3mol乙醇 | 反应开始阶段,反应结束静置一段时间后U形管中液面都是左低右高 | |
| C | 3mL浓硫酸、铁钉 | 3mLNaCl溶液、铁钉 | 铁钉均生锈,U形管中液面左高右低 | |
| D | 3mL水 | 3mL饱和FeSO4溶液 | 一段时间后,U形管中液面左低右高,b管溶液中出现红褐色浑浊物 |
| A. | A | B. | B | C. | C | D. | D |
20.某学生将氯乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到有白色沉淀生成,其主要原因是 ( )
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
7.如表实验设计,能达到相应实验目的是( )
| 序号 | 实验目的 | 实验设计 |
| A | 证明CH2═CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| B | 鉴别碳酸钠溶液与碳酸氢钠溶液 | 分别加入少量的氢氧化钠溶液,观察现象 |
| C | 实验室制取少量O2气体 | 将蒸馏水滴入过氧化钠固体中,用排水法收集产生的气体 |
| D | 除去硫酸铜溶液中少量的硫酸铁 | 加入过量铜粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
10.两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,则混合物的组成可能是( )
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |