题目内容
5.(Ⅰ)将过量稀硫酸加入某混合溶液甲中,产生大量无色无味的温室气体乙,同时得到溶液丙.若在溶液丙中加入过量氨水,析出大量白色沉淀.则:(1)写出气体乙的结构式O=C=O.
(2)溶液甲中肯定不含下列微粒中的A.
A、Fe3+ B、Mg2+ C、CO32- D、AlO2-
(3)溶液丙中加入过量氨水生成白色沉淀,写出可能发生的一个离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+(Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+).
(Ⅱ)已知盐X溶于水后发生如下变化:
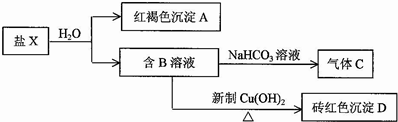
已知:①物质B是最简单的羧酸; ②Cu2O+2H+=Cu+H2O
(1)写出生成气体C的离子反应方程式HCO3-+HCOOH=CO2↑+H2O+HCOO-.
(2)盐X的化学式为Fe(HCOO)3.
(3)有人认为红褐色沉淀A也可和B发生氧化还原反应,写出一个可能的化学反应方程式2Fe(OH)3+5HCOOH=CO2↑+6H2O+2Fe(HCOO)2.请用必要的文字说明能发生反应的原因三价铁具有强氧化性,氧化性大于铜离子,甲酸中的醛基具有还原性,二者能发生氧化还原反应.
(4)设计实验方案证明砖红色沉淀D中是否含有单质铜取一定量的氧化亚铜样品,溶于足量的稀硫酸中,过滤、洗涤、干燥后称重,与等质量纯氧化亚铜的计算量对比,若质量偏大,则样品中含有单质铜.
分析 I 温室气体的成分为二氧化碳,则乙为CO2,加入过量稀硫酸产生二氧化碳气体,则溶液甲中含有碳酸根或碳酸氢根,溶液丙中加入过量氨水生成白色沉淀,溶液中可能含有铝离子或者镁离子,据此答题;
II.物质B是最简单的羧酸,则B为HCOOH,盐X与水反应生成红褐色沉淀A为Fe(OH)3和HCOOH,则盐X为Fe(HCOO)3;甲酸与碳酸氢钠反应生成C为CO2,甲酸与氢氧化铜反应生成D为Cu2O,据此答题.
解答 解:I 温室气体的成分为二氧化碳,则乙为CO2,加入过量稀硫酸产生二氧化碳气体,则溶液甲中含有碳酸根或碳酸氢根,溶液丙中加入过量氨水生成白色沉淀,溶液中可能含有铝离子或者镁离子,
(1)乙为CO2,结构式为O=C=O,
故答案为:O=C=O;
(2)加入过量浓硫酸产生二氧化碳气体,则溶液中含有碳酸根或碳酸氢根,溶液甲一定不能共存的离子是Fe3+,
故选A;
(3)溶液丙中加入过量氨水生成白色沉淀,溶液中可能含有铝离子或者镁离子,方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+(Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+),
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+(Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+);
II.物质B是最简单的羧酸,则B为HCOOH,盐X与水反应生成红褐色沉淀A为Fe(OH)3和HCOOH,则盐X为Fe(HCOO)3;甲酸与碳酸氢钠反应生成C为CO2,甲酸与氢氧化铜反应生成D为Cu2O,
(1)甲酸与碳酸氢钠反应生成二氧化碳,反应方程式为HCO3-+HCOOH=CO2↑+H2O+HCOO-,
故答案为:HCO3-+HCOOH=CO2↑+H2O+HCOO-;
(2)根据上面的分析可知,X为Fe(HCOO)3,
故答案为:Fe(HCOO)3;
(3)氢氧化铁与甲酸发生氧化还原反应的方程式为2Fe(OH)3+5HCOOH=CO2↑+6H2O+2Fe(HCOO)2,原因是三价铁具有强氧化性,氧化性大于铜离子,甲酸中的醛基具有还原性,二者能发生氧化还原反应,
故答案为:2Fe(OH)3+5HCOOH=CO2↑+6H2O+2Fe(HCOO)2;三价铁具有强氧化性,氧化性大于铜离子,甲酸中的醛基具有还原性,二者能发生氧化还原反应;
(4)D为Cu2O,检验砖红色沉淀中含有铜的方法是取一定量的氧化亚铜样品,溶于足量的稀硫酸中,过滤、洗涤、干燥后称重,与等质量纯氧化亚铜的计算量对比,若质量偏大,则样品中含有单质铜,
故答案为:取一定量的氧化亚铜样品,溶于足量的稀硫酸中,过滤、洗涤、干燥后称重,与等质量纯氧化亚铜的计算量对比,若质量偏大,则样品中含有单质铜;
点评 本题考查了物质的性质与推断,涉及结构式、离子反应、离子共存、离子检验等知识,中等难度,物质的推断是解题的关键,注意元素化合物知识的综合应用.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| 选项 | a中试剂 | b中试剂 | 实验现象 |  |
| A | 1mL12mol•L-1浓盐酸0.5gMnO2 | 0.1gCaCO3、1mL 2mol•L-1盐酸 | 红墨水褪色,U形管中液面左右基本持平 | |
| B | 0.1gNa3mol水 | 0.1gNa 3mol乙醇 | 反应开始阶段,反应结束静置一段时间后U形管中液面都是左低右高 | |
| C | 3mL浓硫酸、铁钉 | 3mLNaCl溶液、铁钉 | 铁钉均生锈,U形管中液面左高右低 | |
| D | 3mL水 | 3mL饱和FeSO4溶液 | 一段时间后,U形管中液面左低右高,b管溶液中出现红褐色浑浊物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
| A. | H2O、CO2 | B. | MgF2、H2O2 | C. | NaOH、Ba(OH)2 | D. | NaCl、KCl |
| A. | 该元素为碳 | B. | 该元素的气态氢化物含H 25% | ||
| C. | RO2为极性分子 | D. | RO2与水反应能生成酸 |
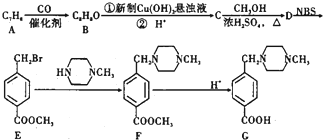

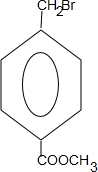 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$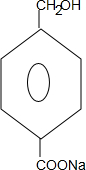 +CH3OH+NaBr
+CH3OH+NaBr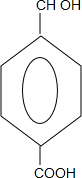 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$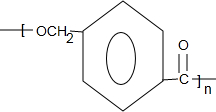 +nH2O
+nH2O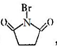 ,则关于NBS与D反应生成E的 说法错误的是 ( )
,则关于NBS与D反应生成E的 说法错误的是 ( ) ;B与空气反应的化学方程式2NO+O2=2NO2.
;B与空气反应的化学方程式2NO+O2=2NO2.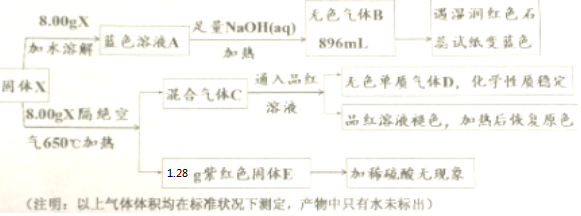
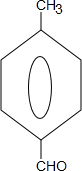
 ;气体D的结构式
;气体D的结构式 .
. 或
或 或CH2=CHCH2OH.
或CH2=CHCH2OH.