题目内容
18.根据元素周期表1~18号元素的性质和递变规律,用适当的元素符号或者化学式回答下列问题.(1)其最高价氧化物对应水化物碱性最强的是NaOH;
(2)最高价氧化物对应的水化物酸性最强的是HClO4;
(3)推测Si、N最简单氢化物的稳定性SiH4小于NH3;
(4)氢化物最稳定的是HF,氢化物水溶液显碱性的是NH3.
分析 (1)金属性最强的元素在周期表的左下角位置,对应的最高价氧化物对应水化物的碱性最强;
(2)元素的非金属性越强,对应的最高价氧化物对应的水化物酸性越强;
(3)同周期元素的原子,从左到右得电子能力逐渐增强,氢化物越来越稳定,同主族元素的原子,从上到下得电子能力逐渐减弱,氢化物越来越不稳定;
(4)非金属性越强氢化物稳定性越强,唯一的氢化物水溶液显碱性的NH3.
解答 解:(1)金属性最强的元素在周期表的左下角位置,元素周期表1~18号元素中Na的金属性最强,其最高价氧化物对应水化物是NaOH,碱性最强,
故答案为:NaOH;
(2)Cl的非金属性仅次于O、F,但O、F无正价,最高价氧化物对应的水化物HClO4酸性最强,故答案为:HClO4;
(3)同周期元素的原子,从左到右得电子能力逐渐增强,氢化物越来越稳定,所以稳定性氨气>甲烷,同主族元素的原子,从上到下得电子能力逐渐减弱,氢化物越来越不稳定,所以稳定性硅烷<甲烷,所以氨气的稳定性强于硅烷,故答案为:SiH4;NH3;
(4)非金属性越强氢化物稳定性越强,F的非金属性最强,其氢化物稳定性最强,唯一的氢化物水溶液显碱性的是NH3,故答案为:HF;NH3.
点评 本题考查元素周期表的结构及应用,侧重元素在周期表的位置及元素周期律的考查,把握原子半径的比较规律及非金属性的比较方法为解答的关键,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
3.用括号中的试剂除去各组物质中的少量杂质正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
6.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.假设常温下在恒容的密闭容器中发生上述反应,试解答下列问题:
(1)上述条件下该反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)能判断该反应达到化学平衡状态的依据是AB.
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1:1
D.NO、CO、CO2、N2的物质的量之比为2:2:2:1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是D.
A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
从表中数据分析可知:
①c=2.70×10-3mol•L-1;
②前2s内的平均反应速率v(N2)=1.875×10-4mol/(L.s);
③该温度下反应的平衡常数K=5×103.
(1)上述条件下该反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)能判断该反应达到化学平衡状态的依据是AB.
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1:1
D.NO、CO、CO2、N2的物质的量之比为2:2:2:1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是D.
A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)( mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)( mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | c | 2.70×10-3 |
①c=2.70×10-3mol•L-1;
②前2s内的平均反应速率v(N2)=1.875×10-4mol/(L.s);
③该温度下反应的平衡常数K=5×103.
13.下列有关碱金属元素的叙述正确的是( )
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
10.两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,则混合物的组成可能是( )
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
7.下列各组物质中,属于同分异构体且属于碳链异构的是( )
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3COOH和HCOOCH3 | D. | CH3CH2CHO和CH3COCH3 |
8.NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |

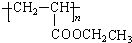 .
. .
. 与
与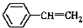 也可以发生类似反应①的反应,其有机产物的结构简式为:
也可以发生类似反应①的反应,其有机产物的结构简式为: .
.