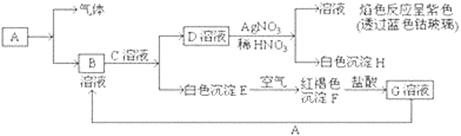
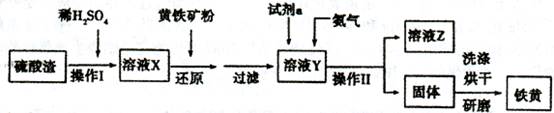
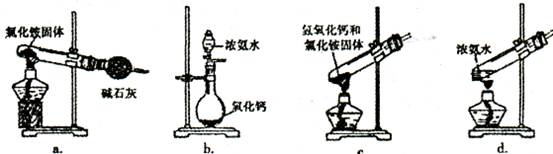
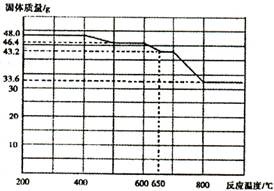
题目内容
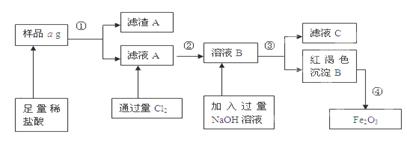
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
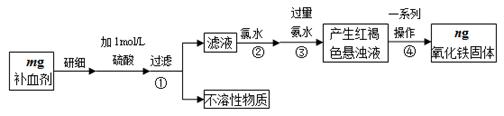
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 。
(2)步骤②加入过量氯水后发生反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 。

(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 。
(2)步骤②加入过量氯水后发生反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 。
| A.KSCN溶液 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液 |
(1)玻璃棒、胶头滴管 (2)2Fe2+ + Cl2 = 2Fe3+ + 2Cl- (3)过滤
(4)70n/m % (5)KSCN 还原性 (6)B
(4)70n/m % (5)KSCN 还原性 (6)B
试题分析:(1)物质的量浓度的溶液在配制时使用的仪器有烧杯、玻璃棒、胶头滴管、500 mL的容量瓶、量筒。(2)在步骤②加入过量氯水把Fe2+氧化为Fe3+.发生反应的离子方程式为2Fe2++Cl2 =2Fe3++ 2Cl-.(3)在步骤④中将Fe(OH)3过滤出来,洗涤干净,然后灼烧,冷却至室温后称量就得Fe2O3的质量。(4)根据Fe守恒可由Fe2O3的质量计算出药品中铁元素的质量,进而计算出Fe元素的质量分数。{(ng÷160g/mol) ×2×56g/mol}÷m×100%="70n/m" %.(5)Fe3+的检验方法是向待测溶液中加入KSCN溶液,若溶液变为血红色,则证明溶液中含有Fe3+.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有还原性的物质。(6)为了检验(5)中滤液中是否有Fe2+应该选用的试剂是酸性KMnO4溶液。现象为溶液的紫色变浅或褪色。选项为B。4·7H2O)中Fe元素的含量的测定及物质的量浓度的溶液的配制、混合物的分离方法、Fe3+的检验等知识。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目

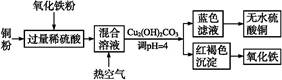
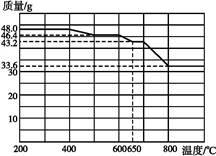
 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。