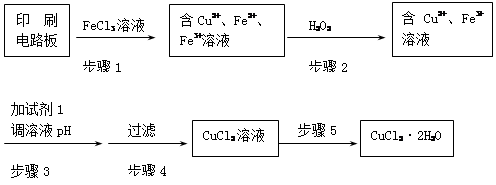题目内容
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸与铜反应制取硫酸铜。该反应的化学方程式是 ,此法的最大缺点是 。
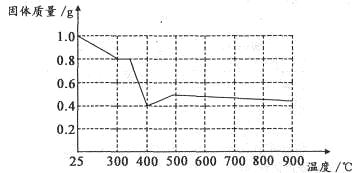
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
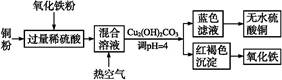
稀硫酸、铜和氧化铁反应的化学方程式是 ;向混合溶液中通入热空气的反应的离子方程式是 ;由滤液得到无水硫酸铜的实验操作是 。
(2)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
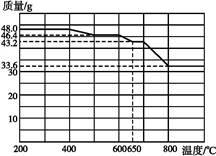
根据图像推断670 ℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论) 。
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
①方法一、用浓硫酸与铜反应制取硫酸铜。该反应的化学方程式是 ,此法的最大缺点是 。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是 ;向混合溶液中通入热空气的反应的离子方程式是 ;由滤液得到无水硫酸铜的实验操作是 。
(2)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。

根据图像推断670 ℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论) 。
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
(1)①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 产生有污染的气体
CuSO4+SO2↑+2H2O 产生有污染的气体
②Fe2O3+6H+ 2Fe3++3H2O、2Fe3++Cu
2Fe3++3H2O、2Fe3++Cu 2Fe2++Cu2+(或Fe2O3+Cu+6H+
2Fe2++Cu2+(或Fe2O3+Cu+6H+ 3H2O+2Fe2++Cu2+)
3H2O+2Fe2++Cu2+)
4Fe2++4H++O2 4F
4F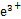 +2H2O 加热、蒸发
+2H2O 加热、蒸发
(2)FeO 取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变为红色,证明还原产物为FeO(要点:三组操作与现象、最终结论)
 CuSO4+SO2↑+2H2O 产生有污染的气体
CuSO4+SO2↑+2H2O 产生有污染的气体②Fe2O3+6H+
 2Fe3++3H2O、2Fe3++Cu
2Fe3++3H2O、2Fe3++Cu 2Fe2++Cu2+(或Fe2O3+Cu+6H+
2Fe2++Cu2+(或Fe2O3+Cu+6H+ 3H2O+2Fe2++Cu2+)
3H2O+2Fe2++Cu2+)4Fe2++4H++O2
 4F
4F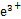 +2H2O 加热、蒸发
+2H2O 加热、蒸发(2)FeO 取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变为红色,证明还原产物为FeO(要点:三组操作与现象、最终结论)
(2)n(Fe2O3)="0.3" mol,反应过程中减少的质量只能是氧元素的质量m(O)="(48-43.2)" g="4.8" g,减少n(O)="0.3" mol,670 ℃时Fe2O3还原产物中n(Fe)=2n(Fe2O3)="0.6" mol、n(O)=3n(Fe2O3)-0.3 mol="0.6" mol,化学式为FeO;要证明还原产物中无铁单质及三价铁

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Cu + SO2
2Cu + SO2