题目内容
某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
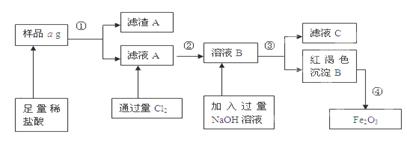
(1)滤液C中溶质含有_ _(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+____ _____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___ __。

(1)滤液C中溶质含有_ _(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+____ _____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___ __。
(1)NaAlO2、NaCl、NaOH (2)取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色。 (3)(7b/10a)×100%
试题分析:(1)样品中加入足量的稀盐酸发生的反应为Fe + 2HCl=FeCl2 + H2↑;2Al+6HCl=2AlCl3+3H2↑滤液中含有FeCl2和AlCl3,滤渣中含有Cu等难溶性杂质。向滤液中通入过量的氯气发生反应2FeCl2+Cl2="=" 2FeCl3,再向溶液中加入过量的NaOH溶液时发生反应AlCl3+4NaOH=3NaCl+NaAlO2+2H2O. FeCl3+3NaOH =3NaCl+Fe(OH)3↓.过滤得到的滤液C中含有NaCl、NaAlO2、NaOH。红褐色沉淀为Fe(OH)3。将其灼烧分解得到Fe2O3和水。(2)验证滤液A中含Fe2+,而不含Fe3+的方法是取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色。或加入氢氧化钠溶液首先产生白色沉淀。白色沉淀迅速变为灰绿色,最后变为红褐色。(3)n(Fe2O3)=bg÷160g/mol.n(Fe)=2×n(Fe2O3)=b/80mol.所以该样品中铁元素质量分数为(b/80mol×56g/mol)÷ag×100%="(7b/10a)×100%" . 3+的检验等知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。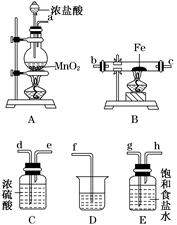
 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。