题目内容
19.氨是最重要的化工产品之一.(1)已知化学反应的能量变化如下
①CO2(g)=CO(g)+1/2O2(g)△H=+282KJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
③1/2O2(g)+H2(g)=H2O(g)△H=-241.8KJ/mol.
合成氨用的氢气可以用甲烷为原料制得,写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1kJ•mol-1
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500,ν(NH3)=5×10-4mol•L-1•S-1,判断该反应是否达到平衡的依据为ABC
A、压强不随时间改变;B、气体的密度不随时间改变 C、C(NH3)不随时间改变 D、ν正(NH3)=ν正(CO)
(4)NH3与NaClO反应可得到肼(N2H4),该化学方程式为2NH3+NaClO=NaCl+N2H4+H2O.
分析 (1)①CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
由盖斯定律②-③×3+①计算;
(2)依据平衡移动方向分析判断需要的条件;
(3)根据化学平衡三段式列式计算平衡浓度,计算平衡常数和反应速率;
依据达到平衡时正逆反应速率是否相等且不等于零这一平衡的标志和达到平衡时各组分的量保持不变这一平衡的特征来判定;
(4)根据氧化还原反应化合价有升必有降,所以NH3与NaClO反应生成肼(N2H4)、氯化钠和水.
解答 解:(1)①CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
由盖斯定律②-③×3+①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1;
(2)吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,故答案为:B;
(3)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g).依据化学方程式和平衡常数概念写出平衡常数K=$\frac{c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{2}(NH{\;}_{3})}$,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%,
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 0.04 0.02 0 0
变化量(mol/L) 0.02 0.01 0 0.01
平衡量(mol/L) 0.02 0.01 0 0.01
K=$\frac{c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{2}(NH{\;}_{3})}$=$\frac{0.01}{0.02{\;}^{2}×0.01}$=2500,ν(NH3)=$\frac{△c}{△t}$=$\frac{0.02mol/L}{40s}$=5×10-4 mol•L-1•S-1;
A.因为反应前后气体系数不等,所以压强不随时间改变能说明达到平衡,故A符合;
B.因为反应前后质量在变,又体积不变,所以气体的密度不随时间改变能说明达到平衡,故B符合;
C.C(NH3)不随时间改变能说明达到平衡,故C符合;
D.ν正(NH3)=ν正(CO)未指明逆反应方向,所以不能说明达平衡状态,故D不符合;
故答案为:2500;5×10-4 mol•L-1•S-1;ABC;
(4)因为氧化还原反应化合价有升必有降,所以NH3与NaClO反应生成肼(N2H4)、氯化钠和水,反应方程式为2NH3+NaClO=NaCl+N2H4+H2O,故答案为:2NH3+NaClO=NaCl+N2H4+H2O.
点评 本题考查了热化学方程式熟悉方法和盖斯电极计算应用,化学平衡计算以及平衡状态的判断等,平衡常数概念的分析应用是解题关键,题目难度中等.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案| A. | 35 Cl和37 Cl | B. | CH3CH2OH和CH3OCH3 | ||
| C. | CH3CH3和CH3CH2CH3 | D. | H2O和H2O2 |
| A. | 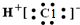 | B. | 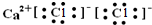 | ||
| C. |  | D. |  |
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | X单质可在氧气中燃烧生成XO3 | |
| C. | 离子半径大小:r (M3+)>r (T2-) | |
| D. | L2+和X2-的核外电子数相等 |
| A. | 0.2mol•L-1醋酸溶液和0.2mol•L-1醋酸钠溶液等体积混合:C(CH3COOH)+C(H+)-C(OH-)=0.1mol•L-1 | |
| B. | pH相等的①(NH4)2SO4②NH4HSO4③NH4Cl溶液:c(NH4+)大小顺序为:①>②>③ | |
| C. | 0.1mol•L-1Na2CO3溶液中c(Na+)+c (H+)=C (CO32-)+c(HCO3-)+c(OH-) | |
| D. | 0.1mol•L-1的NaHB溶液,其中PH=4:c(HB-)>c(H+)>c(H2B)>c(B2-) |
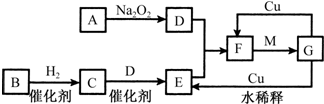
| A. | NH3、H2O、PCl3都是极性分子 | B. | CO2的分子示意图: | ||
| C. | H2O2的电子式: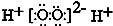 | D. | CS2、C6H6、C2H2都是直线型分子 |
| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 金属腐蚀的本质是金属原子失电子被氧化的过程 | |
| C. | 工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
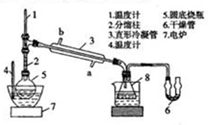 硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:Na2B4O7•10H2O+2H2SO4+12CH3OH=2NaHSO4+4(CH3O)3B+17H2O
| 硼酸三甲酯 | 甲醇 | |
| 相对分子量 | 104 | 32 |
| 溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
| 沸点/℃ | 68 | 64 |
| 备注 | 硼酸三甲酯与甲醇能形成共沸混合物,沸点54℃ | |
在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7•10H2O(硼砂,式量382)然后缓慢地加入浓H2SO4并振荡;用电炉加热烧瓶中的液体;回流一段时间后,先接收51~55℃的馏分,再接收55~60℃的馏分;两次所得馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离;精馏得高纯硼酸三甲酯19.2g.
回答下列问题:
(1)图中仪器8的名称是锥形瓶,直形冷凝管冷却水应从a(填字母)接口进入.
(2)装有P2O3的干燥管作用是防止空气中水蒸气进入导致硝酸三甲酯水解.
(3)采用较高的甲醇与硼砂的物质的量之比的目的是提高硼砂的转化率.
(4)两次馏分中含硼酸三甲酯含量较高的是第1(填“1”或“2”)次.
(5)盐析后分离出硼酸三甲酯所需的主要玻璃仪器是分液漏斗.
(6)精馏时应收集68℃的馏分.
(7)本次实验的产率是D.
A.42.9% B.46.6% C.64.5% D.92.3%
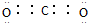 .
. .
. .
.