题目内容
11.下列说法正确的是( )| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 金属腐蚀的本质是金属原子失电子被氧化的过程 | |
| C. | 工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
分析 A.重金属离子能使蛋白质变性而中毒;
B、金属腐蚀的实质是金属失电子的过程;
C、依据工业生产流程和原理分析,陶瓷生产不需要石灰石;
D、相对分子质量在10000以上的有机化合物为高分子化合物;
解答 解:A.重金属盐能使蛋白质变性而中毒,加入少量饱和的硫酸钠溶液会发生盐析,不发生变性,故A错误;
B、金属元素无负价,故金属单质做反应物时一定失电子被氧化,即金属腐蚀的本质是金属原子失电子,发生氧化反应被氧化的过程,故B正确;
C、依据工业生产流程和原理分析,工业生产玻璃、水泥的原料中需要石灰石,陶瓷生产不需要石灰石,故C错误;
D、光导纤维的成分是二氧化硅,为无机物,不是有机高分子化合物,故D错误;
故选B.
点评 本题考查蛋白质的性质和高分子化合物等知识,注意金属单质做反应物时一定失电子被氧化,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
1.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1,可知石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ | |
| D. | 2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 |
2.某烃的结构简式为: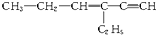 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
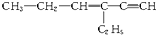 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )| A. | 4,3,5 | B. | 4,3,6 | C. | 2,5,4 | D. | 4,6,4 |
6.下列说法正确的是( )
| A. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| B. | 石油裂解和油脂皂化都是高分子生成小分子的过程 | |
| C. | 分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸 | |
| D. | 乙醇、乙酸和乙醛能用新制Cu(OH)2悬浊液鉴别 |
7.实验室利用冰醋酸和正丁醇制备乙酸正丁酯,实验装置如图1所示,可能用到的有关数据如下表:
合成反应:在干燥的a中加入9.32g正丁醇、7.2mL 冰醋酸和3~4滴浓硫酸,摇匀后,加几粒沸石,c中通水,开始缓慢加热,控制馏出物的温度不超过130℃.
分离提纯:①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;②依次用水、少量的10%碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯7.31g.
请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如图2装置中的B(填序号),使用该仪器前应先检漏.
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.氢氧化钠固体
(6)步骤③得到的粗产品蒸馏提纯时,图3所示装置中,温度计位置可能导致收集到的产品中混有高沸点杂质的装置为D(填序号)
(7)本实验所得到的乙酸正丁酯的产率是C(填序号)
A.30% B.40% C.50% D.55%

| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
分离提纯:①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;②依次用水、少量的10%碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯7.31g.
请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如图2装置中的B(填序号),使用该仪器前应先检漏.
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.氢氧化钠固体
(6)步骤③得到的粗产品蒸馏提纯时,图3所示装置中,温度计位置可能导致收集到的产品中混有高沸点杂质的装置为D(填序号)
(7)本实验所得到的乙酸正丁酯的产率是C(填序号)
A.30% B.40% C.50% D.55%
5.下列各组内的物质,属于同系物的是( )
| A. | 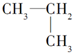 与 与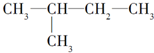 | B. |  与 与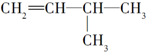 | ||
| C. | HO-CH2-CH2-OH与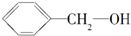 | D. | 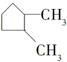 与 与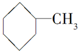 |