题目内容
10.下列电子式书写正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A、氯化氢为共价化合物,分子中存在一个氢氯共用电子对,氯原子最外层一个为8个电子;
B、CaCl2是离子化合物,由钙离子与氯离子构成,为Ca失去2个电子分别给Cl原子形成的;
C、H2O是共价化合物,是由原子和氢原子形成共价键;
D、H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键.
解答 解:A、氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故A错误;
,故A错误;
B、CaCl2是离子化合物,由钙离子与氯离子构成,Ca失去2个电子形成带2个正电荷的阳离子,2个Cl原子分别得到1个电子,形成带1个负电荷的阴离子,电子式为 ,故B错误;
,故B错误;
C、H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,故C错误;
,故C错误;
D、H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故D正确;故选D.
,故D正确;故选D.
点评 本题考查学生电子式的书写知识,题目难度不大,结合物质的成键情况并根据电子式的书写规则解答.

练习册系列答案
相关题目
20. 凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
 凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用发生银镜反应 | D. | 催化剂作用下与H2作用 |
1.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1,可知石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ | |
| D. | 2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 |
18.下列物质中能使干燥的红色石蕊试纸变蓝色的是( )
| A. | 氨气 | B. | 氨水 | C. | 液氨 | D. | 氯化铵 |
5.下列递变情况中,正确的是( )
| A. | Na、Mg、Al原子的最外层电子数依次减少 | |
| B. | N、O、F元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Li、Na、K的金属性依次减弱 |
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,可用于制半导体材料的元素是Si.
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(3)最高价氧化物对应的水化物中酸性最强的是HClO4;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是HF;
(5)在B、C、D中,原子半径由大到小的顺序是Na>Al>C.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(3)最高价氧化物对应的水化物中酸性最强的是HClO4;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是HF;
(5)在B、C、D中,原子半径由大到小的顺序是Na>Al>C.
2.某烃的结构简式为: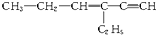 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
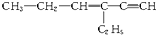 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )| A. | 4,3,5 | B. | 4,3,6 | C. | 2,5,4 | D. | 4,6,4 |
