题目内容
【题目】如图所示,若电解5min时,铜电极质量增加21.6g。
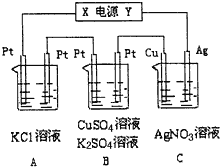
(1)电源电极Y名称为__________(填“正极”或“负极” )。
(2)电解池中溶液的pH变化:A_________,B________(填“增大”、“减小”或“不变”)。
(3)A中发生反应的离子方程式为:_________________,若A中KCl溶液的体积也是200mL,电解后溶液OH-的浓度等于_______。
(4)B中阳极的电极反应式为____________________;若通电5min时B中共收集2.24L气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度约为______。
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式____________
【答案】 正极 增大 减小 2Cl-+2H2O=2 OH-+H2+Cl2 1mol/L 4OH--4e-=2H2O +O2 0.25 mol/L Cu-2e-=Cu2+
【解析】(1)由已知铜电极的质量增加,所以铜电极上发生还原反应,铜电极为阴极,则Ag电极为阳极,电源中Y极是正极。
(2)A为惰性电极电解KCl溶液,总反应为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故电解后A中溶液pH增大;装置B为惰性电极电解硫酸铜溶液,初始阶段总反应的离子方程式为2Cu2++2H2O
Cl2↑+H2↑+2OH-,故电解后A中溶液pH增大;装置B为惰性电极电解硫酸铜溶液,初始阶段总反应的离子方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,故电解后B中溶液pH减小。
2Cu+O2↑+4H+,故电解后B中溶液pH减小。
(3)由上述分析,A中发生反应的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;因为C中铜电极反应为:Ag++e-=Ag,电解5 min时,铜电极增加21.6 g,即生成的Ag为0.2mol,所以电路中转移0.2mol电子,又根据A中反应2H2O+2e-=H2↑+2OH-,则生成OH-物质的量为0.2mol,电解后溶液OH-的浓度为:0.2mol÷0.2L=1molL-1。
Cl2↑+H2↑+2OH-;因为C中铜电极反应为:Ag++e-=Ag,电解5 min时,铜电极增加21.6 g,即生成的Ag为0.2mol,所以电路中转移0.2mol电子,又根据A中反应2H2O+2e-=H2↑+2OH-,则生成OH-物质的量为0.2mol,电解后溶液OH-的浓度为:0.2mol÷0.2L=1molL-1。
(4)装置B为惰性电极电解硫酸铜溶液,所以阳极的电极反应式为:4OH--4e-=2H2O+O2↑;根据前面的分析,电路中转移0.2mol电子,则转移0.2mol电子生成氧气为0.05mol,体积为0.05mol×22.4Lmol-1=1.12L,因为B中共收集到2.24L(标准状况)气体,则在阴极也生成1.12L气体,由反应式2H++2e-=H2↑得,阴极生成氢气转移0.1mol电子,则Cu2++2e-=Cu中转移0.1mol电子,所以Cu2+的物质的量为0.05mol,通电前c(CuSO4)=0.05mol÷0.2L=0.25 mol·L-1。
(5)C装置两极分别为Cu、Ag,电解质溶液为硝酸银溶液,导线连接后形成原电池,Cu作负极失电子发生氧化反应,故负极的电极反应式为:Cu-2e-=Cu2+。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案



