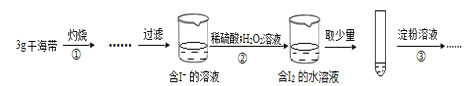
题目内容
【题目】常见铅蓄电池是二次电池,其电极材料分别为Pb和PbO2,电解液为稀H2SO4溶液,工作时的总反应式为Pb +PbO2 + 2H2SO4 ![]() 2PbSO4 +2H2O。请依据上述情况判断:
2PbSO4 +2H2O。请依据上述情况判断:
(1)铅蓄电池的负极材料是________________。
(2)请依据两极材料和总反应,写出放电时正极反应是______________。
(3)请依据总反应式和正极反应式,写出放电时负极反应是________________________。(4)放电时,电解质溶液中阴离子移向______极;电流方向从______极流向______极。
(5)放电时,电解质溶液的酸性_________(填“增强”、“减弱”或“不变”)。
【答案】 Pb PbO2+2e-+4H++SO42-=PbSO4+2H2O Pb-2e-+SO42-= PbSO4 负极 正 负 减弱
【解析】(1)根据电池总反应式可知,Pb元素化合价由0价、+4价变为+2价,因为在原电池中负极发生失电子化合价升高的氧化反应,所以Pb为负极材料。
(2)放电时,正极上PbO2得电子,同时与H2SO4反应生成PbSO4和水,电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O。
(3)放电时,负极Pb失电子发生氧化反应,同时与SO42-反应生成PbSO4,电极反应式为:Pb-2e-+SO42-= PbSO4。
(4)放电时,负极Pb失电子,电子从负极沿外电路流向正极,电流方向与电子运动方向相反,故电流从正极流向负极;阳离子与电流方向形成闭合,阴离子与电子方向形成闭合,所以电解质溶液中阳离子向正极移动、阴离子向负极移动。
(5)放电时,H2SO4参加反应导致溶液中c(H+)降低,故电解质溶液的酸性减弱。

【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序是 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) .
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 .