��Ŀ����
����Ŀ��ij�¶��£�HNO2��CH3COOH�ĵ��볣���քeΪ5.0��10-4��1.7��10-5����pH���������ͬ����������Һ�ֱ�ϡ�ͣ���pH���ˮ����ı仯��ͼ��ʾ������������ȷ����
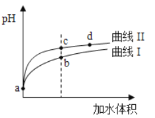
A. ��Һ��ˮ�ĵ���̶ȣ�b��>c��
B. ���ߢ����CH3COOH
C. ��ͬ���a�������Һ�ֱ���NaOHǡ���кͺ���Һ��n(Na+)��ͬ
D. ��c�㵽d�㣬��Һ��![]() ���ֲ��䣨����HA��A-�ֱ������Ӧ�����������ӣ�
���ֲ��䣨����HA��A-�ֱ������Ӧ�����������ӣ�
���𰸡�D
��������
��ĵ���ƽ�ⳣ��Խ��,�������Խǿ,���ݵ���ƽ�ⳣ��֪,���ԣ�HNO2>CH3COOH��
A. ��������ˮ���룬����c(H+)Խ��������ˮ����̶�Խ������c(H+):b>c��������ˮ����̶ȣ�b>c������ˮ����̶ȣ�b<c����A����
B. ��ˮϡ�ʹٽ�������룬pH��ͬ����������ϡ����ͬ������pH�仯������Խ�ǿ������ͼ֪��pH�仯�ϴ����II����II��ʾ��ǿ����HNO2����������I��ʾCH3COOH����B����
C. a��������Һ��pH��ͬ������������ҺŨ�ȣ�HNO2<CH3COOH����ͬ�����a��������Һ���������ʵ�����HNO2<CH3COOH�����ĵļ���������ʵ��������ȣ��������ĵļHNO2<CH3COOH������Naԭ���غ�֪��Һ��n(Na+)��HNO2<CH3COOH����C����
D. ˮ��ƽ�ⳣ��ֻ���¶��йأ�![]() =Kh����c�㵽d�㣬�¶Ȳ��䣬ˮ��ƽ�ⳣ�����䣬������Һ��
=Kh����c�㵽d�㣬�¶Ȳ��䣬ˮ��ƽ�ⳣ�����䣬������Һ��![]() ���ֲ��䣬��D��ȷ��
���ֲ��䣬��D��ȷ��
��ѡD��








