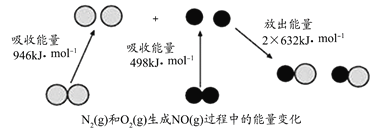
题目内容
【题目】十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。

(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比![]() 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
【答案】-394.0kJ·mol-1 低温 0.25p0 反应I的活化能Ea1较小,反应速率I比II大,0~t1阶段c(SO2)增大,t1后反应II为主,c(CO)减小,使反应I逆向进行,故c(SO2)减小,t2时反应达到平衡状态。 ACD; 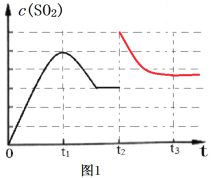
【解析】
(1)反应Ⅰ:CaSO4(s)+CO(g)![]() CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)![]() CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1
根据盖斯定律反应Ⅱ-反应Ⅰ得:CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g),所以,ΔH=ΔH2-ΔH1=-175.6kJ·mol-1-218.4kJ·mol-1=-394.0kJ·mol-1。该反应为气体分子数减小的反应,ΔS<0,ΔH<0,当ΔH-TΔS<0时,反应能自发进行,则T较小的时候反应能自发进行,即该反应在低温时能自发进行,故答案为:-394.0kJ·mol-1;低温;
(2)设参加反应Ⅰ的CO起始的物质的量为a,平衡时,CO和CO2体积分数相等,CO2的体积分数是SO2体积分数的2倍,故设平衡时,SO2的物质的量为xmol,CO和CO2的物质的量为2x,则对于反应Ⅰ有: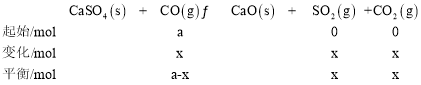
则反应Ⅱ生成的CO2的物质的量为(2x-x)mol=xmol,生成CO的物质的量=[2x-(a-x)]mol=(3x-a)mol,则对于反应Ⅱ有: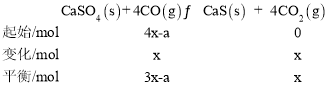
结合反应Ⅰ、Ⅱ可知:CO的充入量为(4x-a)+a=4x,而平衡时,气体的总物质的量=2x+x+2x=5x,设平衡时体系总压为p,则![]() ,解得:p=
,解得:p=![]() ,所以反应Ⅰ的平衡常数Kp=
,所以反应Ⅰ的平衡常数Kp=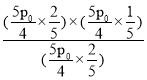 =0.25p0,故答案为:0.25p0;
=0.25p0,故答案为:0.25p0;
(3)因反应Ⅰ的活化能小于反应Ⅱ的活化能,0到t1,反应Ⅰ速率大于反应Ⅱ,c(SO2)增大,t1后反应II为主,c(CO)减小,使反应I逆向进行,故c(SO2)减小,t2时反应达到平衡状态,故答案为:反应I的活化能Ea1较小,反应速率I比II大,0~t1阶段c(SO2)增大,t1后反应II为主,c(CO)减小,使反应I逆向进行,故c(SO
(4)A.反应Ⅰ、Ⅱ都是反应前后气体质量变化的反应,由m=ρV可知,容器体积V恒定下,ρ不变,说明气体总质量m不变,那么容器内每种气体的质量均不变化,已达到平衡,A正确;
B.CaSO4是固体,提高CaSO4的用量,平衡不移动,B错误;
C.反应Ⅰ是吸热反应,升高温度,反应Ⅰ正向移动,SO2体积分数增大,不利于脱硫,C正确;
D.通入氧气,CO被消耗,反应Ⅰ逆向移动,SO2体积分数降低,脱硫效率增大,D正确;
综上所述,ACD满足题意,故答案为:ACD;
(5)容器体积减小一半瞬间,二氧化硫浓度变为2倍,同时压强增大,平衡逆向移动,二氧化硫浓度减小,t2~t3二氧化硫浓度比t1~t2减小的多。根据勒夏特列原理可知,t3重新平衡时,二氧化硫浓度略比t2时刻大,据此如图: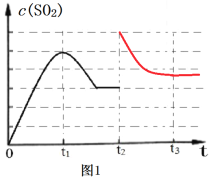 ,故答案为:
,故答案为: 。
。

 阅读快车系列答案
阅读快车系列答案【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,一定容积的密闭容器中,发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A. 25℃达到平衡时,向容器中继续通入CO,Ni粉转化率增大,CO转化率减小
B. 温度越低,越有利于Ni(CO)4的生产
C. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)<v(逆)
D. 平衡时向密闭容器中加入少量镍粉,平衡向正反应方向移动,新平衡时CO浓度比原平衡小
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
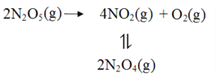
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高