题目内容
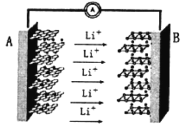
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
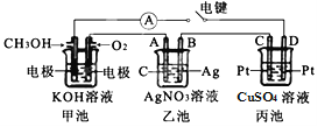
(1)甲池为______(填原电池、电解池或电镀池),通入甲醇电极的电极反应式为________。
(2)乙池中B电极为______(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为________。
(3)当乙池中B极质量增重5.4g时,甲池中理论上消耗O2的体积为______mL(标准状况)。
(4)丙池中,C上的电极反应式为________________。如果起始时盛有1000 mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其质量约为_______g。
(5)若将丙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6g甲醇时,丙中两个电极质量差为______g。
【答案】原电池 CH3OH+8OH--6e-═CO32-+6H2O 阴极 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280 4OH--4e-= O2↑+2H2O或2H2O-4e-= O2↑+4H+ 氧化铜(或碳酸铜) 4 g(或6.2 g) 19.2
4Ag+O2↑+4HNO3 280 4OH--4e-= O2↑+2H2O或2H2O-4e-= O2↑+4H+ 氧化铜(或碳酸铜) 4 g(或6.2 g) 19.2
【解析】
甲池为燃料电池,CH3OH为负极发生氧化反应,氧气为正极发生还原反应,则乙中A为阳极,B为阴极,阳极上氢氧根离子失电子生成氧气,阴极上银离子得电子生成Ag,丙池中C为阳极,D是阴极,也就是惰性电极电解硫酸铜。
(1)甲池为甲醇燃料电池,为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:原电池;CH3OH-6e-+8OH-═CO32-+6H2O;
(2)乙池是电解池,A与甲池中的正极相连,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
答案为:阴极;4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(3)当乙池中B极质量增加5.4g为Ag,物质的量= ![]() =0.05mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=
=0.05mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=![]() mol×22.4L/mol=0.28L=280ml;
mol×22.4L/mol=0.28L=280ml;
答案为:280;
(4)丙池中,C电极与甲池原电池的正极相连,C为阳极,D为阴极,C电极上根据阴离子放电顺序,水中氢氧根离子失去电子转变为水和氧气或可写为水失去电子生成氧气和氢离子,电极反应式为4OH--4e-= O2↑+2H2O或2H2O-4e-= O2↑+4H+;阴极上铜离子放电生成铜,阳极上析出氧气、阴极上析出铜,所以相当于析出CuO,电池反应式为2CuSO4+2H2O ![]() 2H2SO4+2Cu+O2↑,pH=1时溶液中氢离子浓度为0.1mol/L,则溶液中n(H2SO4)=0.05mol/L×1L=0.05mol,阴极析出n(Cu)=n(H2SO4)=0.05mol,根据“析出什么加入什么”原则,根据Cu原子守恒知析出m(CuO)=n(Cu).M(CuO)=0.05mol×80g/mol=4g,也可以加入碳酸铜,其质量=0.05mol×124g/mol=6.2g;
2H2SO4+2Cu+O2↑,pH=1时溶液中氢离子浓度为0.1mol/L,则溶液中n(H2SO4)=0.05mol/L×1L=0.05mol,阴极析出n(Cu)=n(H2SO4)=0.05mol,根据“析出什么加入什么”原则,根据Cu原子守恒知析出m(CuO)=n(Cu).M(CuO)=0.05mol×80g/mol=4g,也可以加入碳酸铜,其质量=0.05mol×124g/mol=6.2g;
答案为:氧化铜(或碳酸铜);4 g(或6.2 g);
(5)若将丙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,则阳极反应为:Cu2e=Cu2+,阴极反应为:Cu2++2e=Cu,当甲中消耗1.6g甲醇时即转移电子为![]()
×6=0.3mol,所以丙中两个电极质量差为64g/mol×0.3mol=19.2g,
故答案为:19.2。

 字词句段篇系列答案
字词句段篇系列答案【题目】已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A.a = 1.64
B.此时刻正反应速率大于逆反应速率
C.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
D.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态