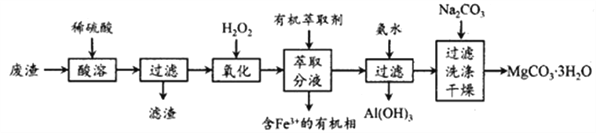
题目内容
【题目】下列为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
关于已知元素C、N、S和未知的元素X、Y、Z,回答下列问题:
(1)Z元素在周期表中的位置为______________。
(2)表中元素原子半径最大的是______________ (写元素符号)。
(3)①S与Z可形成化合物S2Z2,写出它的电子式______________。
②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,写出它的结构式______________。
(4)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体A、B均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________,生成硫酸铜物质的量为______________。
【答案】 第三周期ⅦA族 Si ![]() [S-C
[S-C![]() N]-或[S=C=N]- NO:0.9mol 、NO2:1.3mol 2mol
N]-或[S=C=N]- NO:0.9mol 、NO2:1.3mol 2mol
【解析】根据元素周期表的结构可知X为Si元素,Y为O元素;Z为Cl元素;
(1)Cl元素在周期表中位于第三周期第ⅦA族;(2)同一周期,从左到右,原子半径逐渐减小,同一主族,从上到下,原子半径逐渐增大,表中元素原子半径最大的是Si;(3)①S与Z可形成化合物S2Cl2,含有共价键,根据8电子稳定结构可知它的电子式为![]() ;②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,化学式为SCN-,因此它的结构式[S=C=N]-;(4)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成一氧化氮和二氧化氮,相对分子质量都小于50,符合题意,1molO2参与反应转移电子的物质的量为4mol。假设二氧化氮的物质的量为xmol,一氧化氮的物质的量为ymol,消耗氢氧化钠是2.2mol,根据硝酸钠的化学式结合原子守恒可知x+y=2.2,x+3y=4,解得x=1.3,y=0.9。根据电子得失守恒可知参与反应的铜的物质的量为4mol÷2=2mol,因此生成硫酸铜物质的量为2mol。
;②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,化学式为SCN-,因此它的结构式[S=C=N]-;(4)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成一氧化氮和二氧化氮,相对分子质量都小于50,符合题意,1molO2参与反应转移电子的物质的量为4mol。假设二氧化氮的物质的量为xmol,一氧化氮的物质的量为ymol,消耗氢氧化钠是2.2mol,根据硝酸钠的化学式结合原子守恒可知x+y=2.2,x+3y=4,解得x=1.3,y=0.9。根据电子得失守恒可知参与反应的铜的物质的量为4mol÷2=2mol,因此生成硫酸铜物质的量为2mol。

【题目】从下列事实所列出的相应结论正确的是( )
实验事实 | 结论 | |
① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
② | 浓硫酸可除去烧瓶内残留的MnO2 , 稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3﹣>Al(OH)3 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO |
⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH |
A.②③⑤
B.①②③
C.③④⑤
D.全部