��Ŀ����
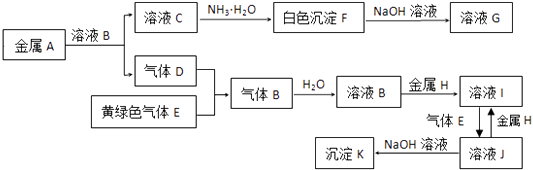
����Ŀ����ĸA��F�������ֲ�ͬ���ʣ�����֮��ɷ�����ͼ��ת�������ַ�Ӧ��������û��ȫ���г���������D��һ��ǿ�E��һ�ֳ����������С�����������������������CO2��ȼ�գ�����ͼʾ�ش��������⣺ 
��1��A����������
��2��E��CO2��ȼ�յĻ�ѧ����ʽΪ��
��3��D��F��Ӧ�Ļ�ѧ����ʽΪ �� �÷�Ӧ��D�������ԣ�
��4��50mL 14molL��1����D����Һ�м���������ͭ����ַ�Ӧ���ռ�������2.24L����״���£�����ԭ��D�����ʵ���Ϊmol���μӷ�Ӧ��ͭ������Ϊg��
���𰸡�
��1��N2��NH3
��2��2Mg+CO2 ![]() 2MgO+C
2MgO+C
��3��C+4HNO3 ![]() CO2��+NO2��+2H2O��������
CO2��+NO2��+2H2O��������
��4��0.1��19.2
���������⣺����D��һ��ǿ�ᣬA��������Ӧ����B��B��������Ӧ����C��˵��BCΪ�����A�����Ƿǽ������ʣ�Ҳ�����Ƿǽ����⻯�E��һ�ֳ����������С��������������������ж�ΪMg������CO2��ȼ������MgO��C��F����D��Ӧ����C�Ͷ�����̼����̼����ķ�Ӧ��Ũ�����Ũ���ᶼ���Է�Ӧ�������ɵIJ��Ǻ�����Ԫ�ػ��ϼ���ͬ������֤��DΪ���ᣬŨ������ϣ��ж�AΪN2��NH3 �� BΪNO��CΪNO2 �� DΪHNO3 �� EΪMg��FΪC����1������������֪DΪ���ᣬ��AΪ������������ѧʽΪ��N2��NH3 �� �ʴ�Ϊ��N2��NH3����2��E��CO2��ȼ�յķ�ӦΪMg�Ͷ�����̼��Ӧ����̼������þ����Ӧ�Ļ�ѧ����ʽΪ��2Mg+CO2 ![]() 2MgO+C���ʴ�Ϊ��2Mg+CO2
2MgO+C���ʴ�Ϊ��2Mg+CO2 ![]() 2MgO+C����3��D��F�ķ�Ӧ��̼��Ũ������ȵķ�Ӧ���ɶ�����̼������������ˮ���������ǿ�����ԣ���Ӧ�Ļ�ѧ����ʽΪ��C+4HNO3
2MgO+C����3��D��F�ķ�Ӧ��̼��Ũ������ȵķ�Ӧ���ɶ�����̼������������ˮ���������ǿ�����ԣ���Ӧ�Ļ�ѧ����ʽΪ��C+4HNO3 ![]() CO2��+NO2��+2H2O����������������ԣ��ʴ�Ϊ��C+4HNO3
CO2��+NO2��+2H2O����������������ԣ��ʴ�Ϊ��C+4HNO3 ![]() CO2��+NO2��+2H2O�������ԣ���4������D����Һ����������Һ�м���������ͭ��50mL14molL��1����D���������Һ�У��������ʵ����ʵ���Ϊ0.7mol����ַ�Ӧ���ռ������壨NO2��NO��2.24L����״���£�����ԭ������Ϊ0.1mol�������ͭ���ӽ�ϵ������Ϊ0.6mol���μӷ�Ӧ��ͭΪ0.3mol������Ϊ0.3mol��64g/mol=19.2g���ʴ�Ϊ��0.1��19.2�� ����D��һ��ǿ�ᣬA��������Ӧ����B��B��������Ӧ����C��˵��BCΪ�����A�����Ƿǽ������ʣ�Ҳ�����Ƿǽ����⻯�E��һ�ֳ����������С��������������������ж�ΪMg������CO2��ȼ������MgO��C��F����D��Ӧ����C�Ͷ�����̼����̼����ķ�Ӧ��Ũ�����Ũ���ᶼ���Է�Ӧ�������ɵIJ��Ǻ�����Ԫ�ػ��ϼ���ͬ������֤��DΪ���ᣬŨ������ϣ��ж�AΪN2��NH3 �� BΪNO��CΪNO2 �� DΪHNO3 �� EΪMg��FΪC����1������������֪DΪ���ᣬ��AΪ������������2��E��CO2��ȼ�յķ�ӦΪMg�Ͷ�����̼��Ӧ����̼������þ����3��D��F�ķ�Ӧ��̼��Ũ������ȵķ�Ӧ���ɶ�����̼������������ˮ���������ǿ�����ԣ���4�����������ͭ��Ӧ��ʼ���ɶ����������������һ��������
CO2��+NO2��+2H2O�������ԣ���4������D����Һ����������Һ�м���������ͭ��50mL14molL��1����D���������Һ�У��������ʵ����ʵ���Ϊ0.7mol����ַ�Ӧ���ռ������壨NO2��NO��2.24L����״���£�����ԭ������Ϊ0.1mol�������ͭ���ӽ�ϵ������Ϊ0.6mol���μӷ�Ӧ��ͭΪ0.3mol������Ϊ0.3mol��64g/mol=19.2g���ʴ�Ϊ��0.1��19.2�� ����D��һ��ǿ�ᣬA��������Ӧ����B��B��������Ӧ����C��˵��BCΪ�����A�����Ƿǽ������ʣ�Ҳ�����Ƿǽ����⻯�E��һ�ֳ����������С��������������������ж�ΪMg������CO2��ȼ������MgO��C��F����D��Ӧ����C�Ͷ�����̼����̼����ķ�Ӧ��Ũ�����Ũ���ᶼ���Է�Ӧ�������ɵIJ��Ǻ�����Ԫ�ػ��ϼ���ͬ������֤��DΪ���ᣬŨ������ϣ��ж�AΪN2��NH3 �� BΪNO��CΪNO2 �� DΪHNO3 �� EΪMg��FΪC����1������������֪DΪ���ᣬ��AΪ������������2��E��CO2��ȼ�յķ�ӦΪMg�Ͷ�����̼��Ӧ����̼������þ����3��D��F�ķ�Ӧ��̼��Ũ������ȵķ�Ӧ���ɶ�����̼������������ˮ���������ǿ�����ԣ���4�����������ͭ��Ӧ��ʼ���ɶ����������������һ��������

����Ŀ��ijУ��ѧʵ����ȤС���ڡ�̽��±�ص��ʵ������ԡ���ϵ��ʵ���з��֣���������ϡ�Ȼ�������Һ�У�����1��2����ˮ������Һ�ʻ�ɫ��
��1��������⣺Fe3+��Br2�ĸ������Ը�ǿ�� ���룺�ټ�ͬѧ��Ϊ�����ԣ�Fe3+��Br2 �� ������ʵ�������Ƿ���������ԭ��Ӧ���£�����Һ�ʻ�ɫ�Ǻ����ѧʽ����ͬ�����£�
����ͬѧ��Ϊ�����ԣ�Br2��Fe3+ �� �����������Ƿ���������ԭ��Ӧ���£�����Һ�ʻ�ɫ�Ǻ����£�
��2�����ʵ�鲢��֤��ͬѧΪ��֤��ͬѧ�Ĺ۵㣬ѡ������ijЩ�Լ���Ƴ����ַ�������ʵ�飬��ͨ���۲�ʵ������֤������ͬѧ�Ĺ۵�����ȷ�ģ� ��ѡ�õ��Լ���a����̪��Һ b��CCl4 c����ˮ�ƾ� d��KSCN��Һ��
�����ڱ���д����ͬѧѡ�õ��Լ���ʵ���й۲쵽������
ѡ���Լ�������ţ� | ʵ������ | |
����1 | ||
����2 |
��3������ �����ԣ�Br2��Fe3+ �� ����������ϡ�Ȼ�������Һ�У�����1��2����ˮ����Һ�ʻ�ɫ�����������ӷ�Ӧ����ʽΪ ��
��4��ʵ����˼�� �ٸ�������ʵ���Ʋ⣬�����廯������Һ��ͨ�����������ȱ������������� ��
����100mLFeBr2��Һ��ͨ��2.24LCl2����״��������Һ���� ![]() ��Br���������ɵ���Br2 �� ��ԭFeBr2��Һ�����ʵ���Ũ��Ϊ ��
��Br���������ɵ���Br2 �� ��ԭFeBr2��Һ�����ʵ���Ũ��Ϊ ��
����Ŀ������ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
������֪Ԫ��C��N��S��δ֪��Ԫ��X��Y��Z���ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ______________��
��2������Ԫ��ԭ�Ӱ뾶������______________ (дԪ�ط���)��
��3����S��Z���γɻ�����S2Z2��д�����ĵ���ʽ______________��
��C��N��S��Ԫ���γɵ������ӳ����ڼ���Fe3+�Ĵ��ڣ�д�����Ľṹʽ______________��
��4��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ���������A��B���ɱ�������Ԫ����ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1L2.2mol��L-1NaOH��Һ��1molO2������������ķ���ʽ�����ʵ����ֱ�Ϊ______________����������ͭ���ʵ���Ϊ______________��