题目内容
18.已知短周期中相邻元素X、Y、Z、W,其原子序数依次增大,其中X、Y、Z三种元素的质子数之和为21,X、Y、Z同周期且相邻,Z与W同族.(1)W在周期表中的位置是第三周期VIA族.用原子结构理论解释Z的非金属性强于W的原因O、S同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱.
(2)恒温恒容下,在一密闭容器中,发生可逆反应Y2(g)+3H2(g)?2YH3(g).
下列各项能说明该反应已达平衡状态的是:②④.
①容器内N2,H2,NH3三者共存
②容器内压强不随时间变化而变化
③容器内密度不再发生变化
④容器内气体平均摩尔质量不随时间的变化而变化
恒温恒容下,2molH2与2molY的单质反应,达到平衡时,Y的单质为1.8mol,H2的转化率为30%;若该反应在恒温恒压条件下进行(其它条件相同),反应达到平衡时,H2的转化率比上述条件下的转化率大(填“大”、“小”或“相同”).
(3)有一种Y元素的液态氢化合物乙,1分子中含有18个电子,是“神舟七号”飞船发射时使用的高能燃料之一.已知:12.8g 液态乙完全燃烧生成Y2和液态H2O时放出热量248.5kJ.请写出该反应的热化学方程式:N2H4(g)+O2(l)?N2(g)+2H2O(l)△H=-621.25 kJ•mol-1.
(4)燃煤过程产生的WZ2是形成酸雨的气体之一,为了减少它对环境的污染,往往在燃煤中加入石灰石,该反应的化学方程式:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2.
分析 短周期中相邻元素X、Y、Z、W,其原子序数依次增大,X、Y、Z同周期且相邻,X、Y、Z三种元素的质子数之和为21,可推知X为C元素、Y为N元素、Z为O元素;Z与W同族,则W为S元素.
(1)同一主族从上到下,原子半径逐渐增大,得电子的能力减弱;
(2)发生可逆反应N2(g)+3H2(g)?2NH3(g).
①反应开始后容器内N2、H2、NH3三者共存;
②恒温恒容下,而随反应进行混合气体总物质的量减小,容器内压强减小,容器内压强不随时间变化而变化说明到达平衡;
③混合气体总质量不变,容器容积不变,密度始终不变;
④容器内气体总质量不变,随反应进行总物质的量减小,平均摩尔质量增大,平均摩尔质量不随时间的变化而变化,说明反应到达平衡;
达到平衡时,N2的单质为1.8mol,则参加反应的N2为2mol-1.8mol=0.2mol,由方程式开始参加反应的H2为0.2mol×3=0.6mol,进而计算氢气转化率;
恒温恒容,随反应进行,混合气体总物质的量减小,则压强减小,若该反应在恒温恒压条件下进行(其它条件相同),等效为在原平衡基础上增大压强,与原平衡相比反应正向移动;
(3)一种Y元素的液态氢化合物乙,1分子中含有18个电子,则乙为N2H4,发生反应:N2H4+O2?N2+2H2O,计算1molN2H4反应放出的热量,证明物质的聚集状态与反应热书写热化学方程式,注意氧气应为液态;
(4)整个可以认为:碳酸钙分解为氧化钙与二氧化碳,氧化钙与二氧化硫反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙,即二氧化硫与碳酸钙、氧气反应生成硫酸钙与二氧化碳.
解答 解:短周期中相邻元素X、Y、Z、W,其原子序数依次增大,X、Y、Z同周期且相邻,X、Y、Z三种元素的质子数之和为21,可推知X为C元素、Y为N元素、Z为O元素;Z与W同族,则W为S元素.
(1)W为S元素,处于周期表中第三周期VIA族,O、S同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱,
故答案为:第三周期VIA族;O、S同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱;
(2)发生可逆反应N2(g)+3H2(g)?2NH3(g).
①反应开始后容器内N2、H2、NH3三者共存,不能说明到达平衡,故错误;
②恒温恒容下,而随反应进行混合气体总物质的量减小,容器内压强减小,容器内压强不随时间变化而变化,说明到达平衡状态,故正确;
③混合气体总质量不变,容器容积不变,密度始终不变,故错误;
④容器内气体总质量不变,随反应进行总物质的量减小,平均摩尔质量增大,平均摩尔质量不随时间的变化而变化,说明反应到达平衡,故正确;
达到平衡时,N2的单质为1.8mol,则参加反应的N2为2mol-1.8mol=0.2mol,由方程式开始参加反应的H2为0.2mol×3=0.6mol,氢气转化率为$\frac{0.6mol}{2mol}$×100%=30%;
恒温恒容,随反应进行,混合气体总物质的量减小,则压强减小,若该反应在恒温恒压条件下进行(其它条件相同),等效为在原平衡基础上增大压强,与原平衡相比反应正向移动,则转化率增大,
故答案为:②④;30%;大;
(3)一种Y元素的液态氢化合物乙,1分子中含有18个电子,则乙为N2H4,12.8g 液态N2H4完全燃烧生成N2和液态H2O时放出热量248.5kJ,则1molN2H4(g)燃烧放出的热量=248.5kJ×$\frac{1mol×32g/mol}{12.8g}$=621.25kJ/mol,反应热化学方程式为:N2H4(g)+O2(l)?N2(g)+2H2O(l)△H=-621.25 kJ•mol-1,
故答案为:N2H4(g)+O2(l)?N2(g)+2H2O(l)△H=-621.25 kJ•mol-1;
(4)整个可以认为:碳酸钙分解为氧化钙与二氧化碳,氧化钙与二氧化硫反应生成亚硫酸钙,亚硫酸钙被氧气氧化为硫酸钙,即二氧化硫与碳酸钙、氧气反应生成硫酸钙与二氧化碳,反应方程式为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,
故答案为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2.
点评 本题考查结构性质位置关系应用,涉及元素周期律、化学平衡状态判断、化学平衡计算与影响因素、热化学方程式书写等,是对学生综合能力考查,(3)中热化学方程式书写为易错点,学生容易忽略氧气聚集状态.

| A. | 石油和植物油都是混合物,且属于不同类的有机物 | |
| B. | 甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 | |
| C. | 用酸性K2Cr2O7 溶液鉴别乙醇与乙醛溶液 | |
| D. | 纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2 (g)+O2 (g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 | |
| D. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 |
| A. | 电解饱和食盐水可冶炼金属钠 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 铝热反应中的铝热剂是混合物 | |
| D. | 凡含有添加剂的食物对人体健康均有害,不宜食用 |
| A. | 将少量的金属钠分别投入CuSO4溶液中,有气体放出,且溶液质量减轻 | |
| B. | 露置在空气中的金属钠表面迅速变暗,是因为钠与空气中的氧气反应生成了氧化钠 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 在含有Na+、Cl-、CO${\;}_{3}^{2-}$、SO${\;}_{3}^{2-}$的溶液中加入足量Na2O2后,各离子仍能大量共存 |
 一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种.为了确定溶液的组成,进行了如下操作:
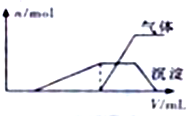
一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种.为了确定溶液的组成,进行了如下操作:(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加
入NaOH溶液的体积关系如图所示;
则该溶液中一定存在的离子是Al3+、H+、NH4+,一定不存在的离子是ClO-、AlO2-.
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如图所示,回答下列问题:
| Cl2的体积(标况下) | 2.8L | 5.6L | 11.2L |
| n(Cl- ) | 1.25mol | 1.5mol | 2mol |
| n(Br- ) | 1.5mol | 1.4mol | 0.9mol |
| n(I- ) | a mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.