题目内容
15. t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| B. | 在t℃时,Ag2CrO4的Ksp=1×10-12 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
分析 A、已知t℃时AgCl的Ksp=2×10-10,由A 知Ag2CrO4的Ksp为1×10-12,则S(AgCl)=$\sqrt{{K}_{SP}}=\sqrt{2×1{0}^{-10}}$=1.41×10-5,而S(Ag2CrO4)=$\root{3}{\frac{{K}_{SP}}{4}}=\frac{\root{3}{2}}{2}$×10-4;
B、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
C、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
D、用AgNO3溶液滴定过程中,AgCl先沉淀出来,待AgCl定量沉淀后,过量的一滴AgNO3溶液即与K2CrO4反应,形成Ag2CrO4砖红色沉淀.
解答 解:A、t℃时AgCl的Ksp=2×10-10,由A 知Ag2CrO4的Ksp为1×10-12,则S(AgCl)=$\sqrt{{K}_{SP}}=\sqrt{2×1{0}^{-10}}$=1.41×10-5,而S(Ag2CrO4)=$\root{3}{\frac{{K}_{SP}}{4}}=\frac{\root{3}{2}}{2}$×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,故A错误;
B、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-,
Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故B正确;
C、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故C错误;
D、用AgNO3溶液滴定过程中,由于AgCl的溶解度小,AgCl先沉淀出来,待AgCl定量沉淀后,过量的一滴AgNO3溶液即与K2CrO4反应,形成Ag2CrO4砖红色沉淀,则有砖红色沉淀生成时即达到终点,所以能采用K2CrO4溶液为指示剂,故D错误,故选B.
点评 本题考查了沉淀溶解平衡的分析判断、溶度积常数的计算应用等,侧重于考查学生的分析能力和计算能力,题目难度中等.

 一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )| 选项 | 操作与现象 | 解释与推论 |
| A | 电池放电时化学能转化为电能 | Zn(s)+Cu2+(aq)=Zn2++Cu(s)△H>0 |
| B | 该电池充电时铜棒变细 | 两电极区溶液颜色都变深 |
| C | 该电池放电时铜棒是电池正极 | Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D | 该电池充电时a接电源正极 | 电极反应Cu2++2e-=Cu |
| A. | A | B. | B | C. | C | D. | D |
| A. | 所得的分散系属于胶体,可发生丁达尔效应 | |
| B. | 所得的分散系中,分散质的主要成分为FeO | |
| C. | 该分散系进行电泳实验时,阳极周围黑色加深 | |
| D. | 往油酸钠水溶液中滴加浓溴水振荡,无明显现象 |
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | 升高温度,不影响活化分子百分数 | |
| C. | 使用催化剂使该反应的反应热发生改变 | |
| D. | E1-E2=△H |
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 0.1 mol Fe与足量稀HNO3反应,转移电子数为0.3NA |

| A. | 该X的分子式为C23H25N2O3 | |
| B. | 每个X分子中含有2个手性碳原子 | |
| C. | 1 mol X最多能与9 mol H2发生加成反应 | |
| D. | X能发生水解、氧化和消去反应 |
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c | |
| B. | 常温下5.0×10-3mol/LKHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(OH)2(s)?M2+(aq)+2OH-(aq)Ksp=a; 当含M(OH)2固体的悬浊液中 c(M2+)=b mol/L时,溶液的pH等于14+$\frac{1}{2}1g(\frac{b}{a})$ | |
| D. | 图中a点溶液中各离子浓度的关系是: c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| A. | Cu | B. | Fe | C. | SO2 | D. | I- |

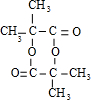 .
. ;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.
;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.