题目内容
20.NA表示阿伏加德罗常数.下列说法正确的是( )| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 0.1 mol Fe与足量稀HNO3反应,转移电子数为0.3NA |
分析 A、过氧化钠是由钠离子与过氧根离子构成;
B、标况下,三氯甲烷为液态;
C、Al3+是弱碱阳离子,在溶液中会水解;
D、铁与足量硝酸反应生成三价铁离子.
解答 解:A、过氧化钠是由钠离子与过氧根离子构成,7.8gNa2O2的物质的量为0.1mol,含有阴离子数目为0.1NA,故A错误;
B、标况下,三氯甲烷为液态,故不能根据气体摩尔体积来计算,故B错误;
C、Al3+是弱碱阳离子,在溶液中会水解,故溶液中铝离子的物质的量小于0.2mol,即小于0.2NA个,故C错误;
D、0.1 mol Fe与足量稀HNO3反应生成0.1mol硝酸铁,转移电子数为0.3NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是( )
| A. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置,分液,得到下层液体 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| D. | 用pH计分别测定0.1mol/L的FeCl3和0.01mol/L的FeCl3的pH,可以比较浓度对盐类水解程度的影响 |
11.以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.4kJ/mol;完成下列填空:
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=c4(NH3)•c3(O2)c2(N2).
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
第四组实验中以NH3表示反应的速率是33×10-7mol/L•h,与前三组相比,NH3 生成量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=c4(NH3)•c3(O2)c2(N2).
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).
8.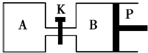 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )| A. | 500℃达平衡时有:c1>c2 | |
| B. | 500℃达平衡时有:a>b>c | |
| C. | 达平衡后打开K,容器B的体积将减小 | |
| D. | 此反应的平衡常数随温度升高而增大 |
15.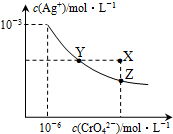 t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| B. | 在t℃时,Ag2CrO4的Ksp=1×10-12 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
5.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
组别 | 甲 | 乙 | 丙 |
| A | NO | NH3 | H2O |
| B | CO2 | Na2CO3 | Ba(OH)2 |
| C | Al | Fe2O3 | HCl |
| D | Cl2 | FeCl2 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
17.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A. | 蛋白质、棉花、核酸、PVC、淀粉都是由高分子组成的物质 | |
| B. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
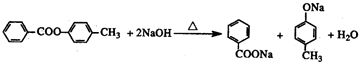
 ,化合物C和化合物N的合成路线如下:
,化合物C和化合物N的合成路线如下: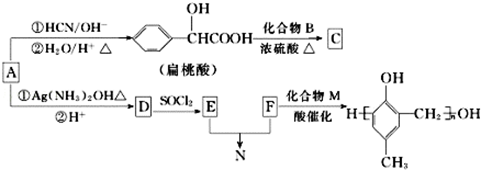
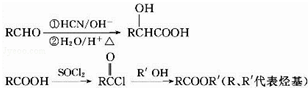
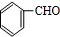 ,D的含氧官能团的名称是羧基.
,D的含氧官能团的名称是羧基.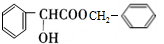 .
.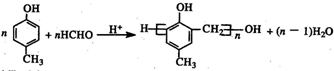 .
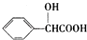
. .
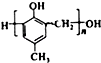
. )有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式
)有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式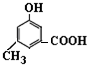 .
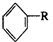
.
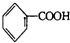
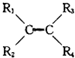
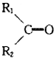 +
+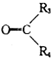 (其中R、R1、R2、R3和R4均表示烃基)今有A~K等11种不同的有机物,它们之间的转化关系如下.其中A为烃,1mol A可得2mol B,E与G为同分异构体.
(其中R、R1、R2、R3和R4均表示烃基)今有A~K等11种不同的有机物,它们之间的转化关系如下.其中A为烃,1mol A可得2mol B,E与G为同分异构体.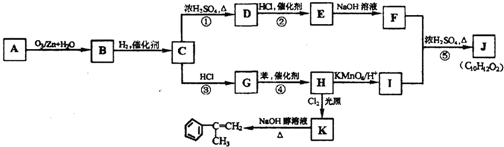
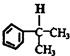 .
.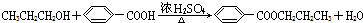 .
.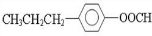 、
、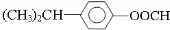 、
、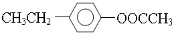 、
、 .
.