题目内容
【题目】下列实验结论与实验操作及现象相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A. | 向某溶液中加入HCl 溶液,产生的气体使澄清的石灰水变浑浊 | 该溶液中含有CO32- |
B. | 向某溶液中通入Cl2,再加入KSCN溶液,溶液变红 | 该溶液中一定含有Fe2+ |
C. | 铁粉加入CuSO4溶液中,析出红色固体 | 氧化性:Fe2+ > Cu2+ |
D. | 向FeCl3溶液中滴加浓的维生素C溶液,黄色褪去 | 维生素C具有还原性 |
A.AB.BC.CD.D
【答案】D
【解析】
A.原溶液中也可能是![]() ,甚至可能是
,甚至可能是![]() 或
或![]() ,A项错误;
,A项错误;
B.仅根据现象无法说明使溶液变红的![]() 是一开始就有的,还是原溶液中的
是一开始就有的,还是原溶液中的![]() 被氯气氧化产生的,若想检测
被氯气氧化产生的,若想检测![]() 的存在应改变试剂的加入顺序,B项错误;
的存在应改变试剂的加入顺序,B项错误;
C.铁和硫酸铜的反应中,![]() 是氧化剂,
是氧化剂,![]() 是氧化产物,根据同一氧化还原反应中氧化性:氧化剂>氧化产物的规律,应该是
是氧化产物,根据同一氧化还原反应中氧化性:氧化剂>氧化产物的规律,应该是![]() 的氧化性强于
的氧化性强于![]() ,C项错误;
,C项错误;
D.![]() 是黄色的且具有氧化性,若黄色褪去说明
是黄色的且具有氧化性,若黄色褪去说明![]() 被还原,则维生素C具有还原性,D项正确;
被还原,则维生素C具有还原性,D项正确;
答案选D。

【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
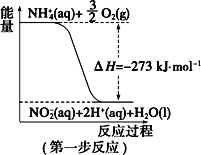
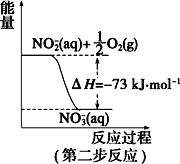
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
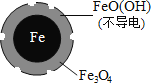
(1)Fe还原水体中NO3-的反应原理如图所示。
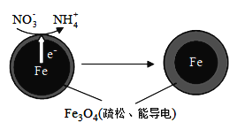
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
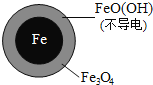
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。