题目内容
【题目】H2S 在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
(一)H2S 是煤化工原料气脱硫过程的重要中间体。反应原理为
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂 1mol 气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ/mol | 1310 | 442 | x | 678 | 930 | 1606 |
(1)计算表中 x=____________。
(2)向VL容积不变的密闭容器中充入1molCOS(g)、amolH2(g)和1molH2O(g),发生上述两个反应,其他条件不变时,容器内CO的平衡体积分数与温度(T)的关系如下图所示。

已知:TIK时测得平衡体系中COS为0.80mol,H2为0.85mol。
① 随着温度的升高,CO的平衡体积分数增大,理由是____________。
② a=______。T1K时CO的平衡转化率为_______
③ T1K 时容器内总压强为pMPa,用气体分压代替气体浓度计算反应l 压强平衡常数Kp=____气体组分的分压=总压强×(气体组分的物质的量/气体总物质的量)(结果保留2位小数)。
(3)少量的羰基硫(COS)用氢氧化钠溶液处理的过程如下(部分产物已略去):
![]()
下图是反应Ⅱ中,在不同温度下,反应时间与H2产量的关系图(Na2S的初始含量为3mol),
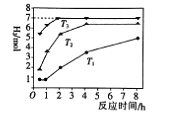
① Na2S溶液显_______(“酸性”或“碱性”)。
② 判断Tl、T2、T3的大小:_______。
(二)H2S 用于金属离子的鉴定。
(4)已知:25℃时,K(sp)(SnS)= 1.0×10-25, K(sp)(CdS)= 8.0×10-27。该温度下,向浓度均为0.1mol/L的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=______(溶液体积变化忽略不计)。
【答案】 1076 反应i为吸热反应,身高温度,平衡正向移动,CO的平衡体积分数增大。反应ii为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大 1 20% 0.044 碱性 T3>T2>T1 8.0×10-3mol/L
【解析】(1)根据反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol =反应为的键能之和-生成物的键能之和=(x+930)-(1606+442),解得x=1076,故答案为:1076;
CO2(g)+H2(g) △H=-42kJ/mol =反应为的键能之和-生成物的键能之和=(x+930)-(1606+442),解得x=1076,故答案为:1076;
(2)①、① COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol ,反应为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大,②CO(g)+H2O(g)
H2S(g)+CO(g) △H=+7kJ/mol ,反应为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大,②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol,反应为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大,故答案为:反应①为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大。反应②为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大;
CO2(g)+H2(g) △H=-42kJ/mol,反应为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大,故答案为:反应①为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大。反应②为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大;
② COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始(mol)1 a 0 0
反应 0.2 0.2 0.2 0.2
平衡 0.8 a-0.2 0.2 0.2
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol)0.2 1 0 a-0.2
反应 x x x x
平衡 0.2-x 1-x x a-0.2+x
则a-0.2+x=0.85,根据图像,平衡时CO的平衡体积分数为5%,因此5%=![]() ×100%,解得a=1,x=0.05,COS的平衡转化率
×100%,解得a=1,x=0.05,COS的平衡转化率![]() ×100%=20%,故答案为:1;20%;
×100%=20%,故答案为:1;20%;
③根据上述计算可知COS(g)+H2(g)![]() H2S(g)+CO(g) 平衡时的物质的量分别为COS0.8mol,H20.85mol,H2S 0.2mol,CO0.15mol,气体的总物质的量为3mol,Kp=
H2S(g)+CO(g) 平衡时的物质的量分别为COS0.8mol,H20.85mol,H2S 0.2mol,CO0.15mol,气体的总物质的量为3mol,Kp= =0.044,故答案为:0.044;
=0.044,故答案为:0.044;
(3)① Na2S属于强碱弱酸盐,水解溶液显碱性,故答案为:碱性;
②由图可知,温度高的反应速率大,则反应的时间短,则T3>T2>T1,故答案为:T3>T2>T1;
(4)根据K(sp)(SnS)= 1.0×10-25,当Sn2+开始沉淀时,溶液中c(S2-)=![]() =1.0×10-24mol/L,此时溶液中c(Cd2+)=
=1.0×10-24mol/L,此时溶液中c(Cd2+)=![]() = 8.0×10-3mol/L,故答案为: 8.0×10-3mol/L。
= 8.0×10-3mol/L,故答案为: 8.0×10-3mol/L。