题目内容
【题目】下列关于物质的分离提纯不正确的是( )
A. 用如图1所示装置分离CCl4和水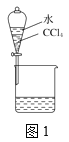
B. 除去苯中的少量苯酚,加入适量浓溴水,过滤
C. 实验室用如图2所示装置除去Cl2中的少量HCl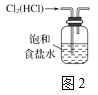
D. 除去O2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
【答案】B
【解析】A.CCl4和水分层,则图中分液漏斗分液可分离,故A正确;B.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液、分液,故B错误;C.HCl极易溶于水,食盐水抑制氯气的溶解,且导管长进短出可除杂,故C正确;D.SO2与高锰酸钾反应,氧气不能,且浓硫酸可干燥氧气,则将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶可除杂,故D正确;故选B。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】H2S 在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
(一)H2S 是煤化工原料气脱硫过程的重要中间体。反应原理为
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂 1mol 气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ/mol | 1310 | 442 | x | 678 | 930 | 1606 |
(1)计算表中 x=____________。
(2)向VL容积不变的密闭容器中充入1molCOS(g)、amolH2(g)和1molH2O(g),发生上述两个反应,其他条件不变时,容器内CO的平衡体积分数与温度(T)的关系如下图所示。

已知:TIK时测得平衡体系中COS为0.80mol,H2为0.85mol。
① 随着温度的升高,CO的平衡体积分数增大,理由是____________。
② a=______。T1K时CO的平衡转化率为_______
③ T1K 时容器内总压强为pMPa,用气体分压代替气体浓度计算反应l 压强平衡常数Kp=____气体组分的分压=总压强×(气体组分的物质的量/气体总物质的量)(结果保留2位小数)。
(3)少量的羰基硫(COS)用氢氧化钠溶液处理的过程如下(部分产物已略去):
![]()
下图是反应Ⅱ中,在不同温度下,反应时间与H2产量的关系图(Na2S的初始含量为3mol),
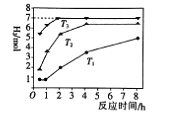
① Na2S溶液显_______(“酸性”或“碱性”)。
② 判断Tl、T2、T3的大小:_______。
(二)H2S 用于金属离子的鉴定。
(4)已知:25℃时,K(sp)(SnS)= 1.0×10-25, K(sp)(CdS)= 8.0×10-27。该温度下,向浓度均为0.1mol/L的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=______(溶液体积变化忽略不计)。
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
熔点/ ℃ | 16.6 | -89.5 | -73.5 |
沸点/ ℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
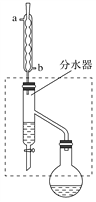
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。