题目内容
下列物质中,属于弱电解质的是( )
| A.氨水 | B.冰醋酸 | C.酒精 | D.硫酸钡 |
B
试题分析:电解质是在水溶液中或熔化状态下能够导电的化合物。弱电解质是在水溶液中只有部分电离产生离子的电解质。A.氨水是混合物。错误。B.冰醋酸在水分子的作用下,部分发生电离:CH3COOH
 CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。
CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。
练习册系列答案
相关题目
 H++S2-
H++S2- H++HS-和HS-
H++HS-和HS- Na2CO3 + 2HClO
Na2CO3 + 2HClO H++HS-和HS-
H++HS-和HS-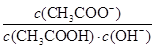 不变
不变
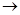 SO32— + 2HClO
SO32— + 2HClO