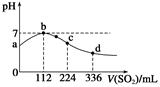
题目内容
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:2NaClO + CO2 + H2O Na2CO3 + 2HClO
Na2CO3 + 2HClO
B.过量的HCN滴入碳酸钠溶液中HCN + Na2CO3 NaCN+ NaHCO3
NaCN+ NaHCO3
C.结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN)
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:2NaClO + CO2 + H2O
 Na2CO3 + 2HClO
Na2CO3 + 2HClOB.过量的HCN滴入碳酸钠溶液中HCN + Na2CO3
 NaCN+ NaHCO3
NaCN+ NaHCO3C.结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN)
BC
试题分析:A、碳酸钠溶液的pH大于次氯酸钠溶液的pH,说明前者水解程度大,因此酸性是次氯酸强于碳酸氢钠,则少量二氧化碳通入NaClO溶液中:NaClO + CO2 + H2O
 NaHCO3 + HClO,A不正确;B、NaCN溶液的pH介于碳酸氢钠和碳酸钠之间,所以酸性是碳酸>HCN>HCO3—,所以过量的 HCN滴入碳酸钠溶液中 HCN + Na2CO3
NaHCO3 + HClO,A不正确;B、NaCN溶液的pH介于碳酸氢钠和碳酸钠之间,所以酸性是碳酸>HCN>HCO3—,所以过量的 HCN滴入碳酸钠溶液中 HCN + Na2CO3 NaCN+ NaHCO3,B正确;C、酸越弱相应的钠盐越容易水解,则根据溶液的pH值可知酸性强弱顺序为CH3COOH> H2CO3>HClO>HCN>C6H5OH)>HCO3—,所以结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—,C正确;D、常温下电离常数:Ki2(H2CO3)>Ki(HCN) >Ki(C6H5OH),D不正确,答案选BC。
NaCN+ NaHCO3,B正确;C、酸越弱相应的钠盐越容易水解,则根据溶液的pH值可知酸性强弱顺序为CH3COOH> H2CO3>HClO>HCN>C6H5OH)>HCO3—,所以结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—,C正确;D、常温下电离常数:Ki2(H2CO3)>Ki(HCN) >Ki(C6H5OH),D不正确,答案选BC。
练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
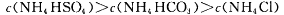
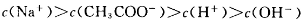
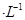 Na2CO3溶液中:
Na2CO3溶液中: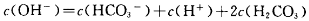
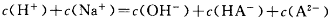
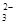 和OH-
和OH- 、H+、CO
、H+、CO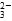 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。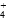 )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。