题目内容
【题目】氮是化肥工业和化工生产的主要原料,工业上合成氨使用的氢气主要来自合成气(CO、H2混合气体)。请回答下列问题:
(1)工业上合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH 。 已知:
2NH3(g) ΔH 。 已知:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 945.6 | 391 |
化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。上述反应的ΔH________________。
(2)联氨(又称肼,N2H4),试写出联氨的电子式_________;联氨又可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1
N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2
则N2(g)+2O2(g)=N2O4 (l) ΔH3=_________
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。a电极反应式为________。若该燃料电池消耗标准状况下6.72 L空气(假设空气中O2体积分数为20%),则理论上消耗NH3的质量为_______g。

(4)甲醇燃料电池在生活应用也很广泛,在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。写出该电池的负极反应式______________。
【答案】-92.4 kJ/mol ![]() 2ΔH2 –ΔH1 2NH3-6e-+6OH-===N2+6H2O 1.36 CH3OH-6e-+3CO32-=4CO2↑+2H2O
2ΔH2 –ΔH1 2NH3-6e-+6OH-===N2+6H2O 1.36 CH3OH-6e-+3CO32-=4CO2↑+2H2O
【解析】
(1)旧键的断裂吸热,新键的形成放热;
(2)联氨的结构简式为H2N-NH2;根据盖斯定律进行计算;
(3)根据装置图,a电极为负极;利用电池两极转移电子数目相同进行计算;
(4)根据电解质的成分,则甲醇失电子,与碳酸根离子反应,生成二氧化碳和水。
(1)旧键的断裂吸热,新键的形成放热,反应热等于反应物的总键能减去生成物的总键能,则ΔH=945.6+436×3-391×6=-92.4kJ/mol;
(2)联氨的结构简式为H2N-NH2,则电子式为![]() ;①2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1,②N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2,根据盖斯定律,②×2-①即可得到N2(g)+2O2(g)=N2O4 (l),ΔH3=2ΔH2-ΔH1;
;①2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1,②N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2,根据盖斯定律,②×2-①即可得到N2(g)+2O2(g)=N2O4 (l),ΔH3=2ΔH2-ΔH1;
(3)根据装置图可知,a电极通入氨气,生成氮气,化合价升高,失电子,作电池的负极;n(O2)=6.72 L×20%/22.4L/mol=0.06mol,化合价由0价变为-2价,转移0.24mol电子,消耗1mol NH3,转移3mol电子,转移0.24mol电子,消耗0.08mol NH3,即1.36g;
(4)Li2CO3和Na2CO3混合物作电解质,则甲醇失电子,与碳酸根离子反应,生成二氧化碳和水,负极反应式为CH3OH-6e-+3CO32-=4CO2↑+2H2O。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚(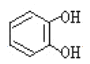 )和对苯二酚(
)和对苯二酚(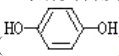 )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
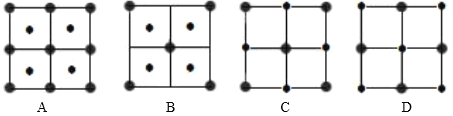
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。
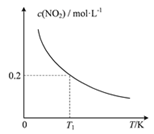
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
容器 编号 | 温度/K | 起始物质的量/mol | |||
SO2 | NO | NO2 | S | ||
Ⅰ | 0.5 | 0.6 | 0 | 0 | |
Ⅱ | T1 | 0.5 | 1 | 0.5 | 1 |
Ⅲ | T2 | 0.5 | 0.2 | 1 | 1 |
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
