��Ŀ����
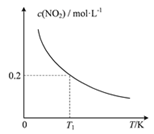
����Ŀ����3�������Ϊ1 L�ĺ����ܱ������з�����Ӧ��SO2(g)��2NO(g)![]() 2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶ȣ�ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����
2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶ȣ�ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����
���� ��� | �¶�/K | ��ʼ���ʵ���/mol | |||
SO2 | NO | NO2 | S | ||
�� | 0.5 | 0.6 | 0 | 0 | |
�� | T1 | 0.5 | 1 | 0.5 | 1 |
�� | T2 | 0.5 | 0.2 | 1 | 1 |
A. �÷�Ӧ�Ħ�H<0
B. T1ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ![]()
C. �����������������T1ʱ�ﵽƽ�⣬��ѹǿ֮��С��1:2
D. ��T2<T1���ﵽƽ��ʱ����������NO���������С��40%
���𰸡�AD
��������A������ͼ���¶����ߣ�ƽ��ʱNO2Ũ�Ƚ��ͣ�˵���¶����߿�ʹ��ѧƽ������
B��T1�¶ȷ�Ӧ�ﵽƽ��ʱc��NO2��=0.2mol/L�����ݷ�Ӧ����ʽ���㣻
C������pV=nRT�����������ݻ��ͷ�Ӧ�¶�һ������ϵ��ѹǿ����ϵ�л������������ʵ��������ȣ�
D���¶Ƚ��ͣ������ڻ�ѧ��Ӧ������У����ݷ�Ӧ����ʽ�͵�Чƽ���֪ʶ������
A������ͼ���¶����ߣ�ƽ��ʱNO2Ũ�Ƚ��ͣ�˵���¶����߿�ʹ��ѧƽ�������������ӦΪ���ȷ�Ӧ������H��0��A��ȷ��
B��T1�¶ȷ�Ӧ�ﵽƽ��ʱc��NO2��=0.2mol/L����ƽ��ʱc��SO2��=0.5mol/L-0.1mol/L=0.4mol/L��c��NO��=0.6mol/L-0.2mol/L=0.4mol/L�����Է�Ӧ�Ļ�ѧƽ�ⳣ��ΪK=c2(NO2)/c2(NO)c(SO2)=
0.22/0.42��0.4=5/8��B����
C��������������״̬����pV=nRT�����������ݻ��ͷ�Ӧ�¶�һ������ϵ��ѹǿ����ϵ�л������������ʵ��������ȣ��������൱�ڰ�0.75molSO2��1.5molNO��0.75molS��ʼ������S�ǹ��壬���ı�Ũ���̣����������з�Ӧ�ﵽƽ��ʱ������ymolSO2����ƽ��ʱ������ѹ����ΪpI/pII=(0.4+0.4+0.2+0.1)/(2y)��1/(2y)��1/2��C����
D��T2��T1�����¶Ƚ��������ڻ�ѧ��Ӧ������У��������൱����1molSO2��1.2molNO��0.5molS��ʼ��S���Ի�ѧ��Ӧ��ƽ�����Ӱ�죬Ҳ���൱�ڶ��������ѹ����ƽ�ⲻ�����ƶ�����ƽ��ʱNO���������Ϊ40%����������Ļ�ѧ��Ӧ������г̶ȱ�����I������ﵽƽ��ʱ����������NO���������С��40%��D��ȷ����ѡAD��

����Ŀ�����ǻ��ʹ�ҵ�ͻ�����������Ҫԭ�ϣ���ҵ�Ϻϳɰ�ʹ�õ�������Ҫ���Ժϳ���(CO��H2�������)����ش��������⣺
��1����ҵ�Ϻϳɰ��ķ�Ӧԭ��ΪN2(g)��3H2(g)![]() 2NH3(g) ��H �� ��֪��
2NH3(g) ��H �� ��֪��
��ѧ�� | H��H | N��N | N��H |
����/kJ��mol-1 | 436 | 945.6 | 391 |
��ѧ���ļ������γɻ����1 mol ��ѧ���ų������յ���������λΪkJ/mol��������Ӧ����H________________��
��2���������ֳ��£�N2H4������д�������ĵ���ʽ_________�������ֿ���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪��2N2H4(l)��N2O4(l)=3N2(g)��4H2O(g) ��H1
N2H4(l)��O2(g)= N2(g)��2H2O(g) ��H2
��N2(g)��2O2(g)=N2O4 (l) ��H3��_________
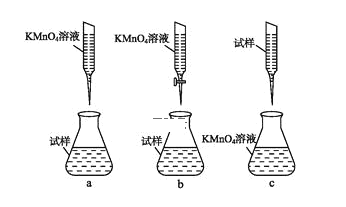
��3�����������������з���ȼ�ϵ���ǵ�ǰ���е�һ���ȵ㡣��ȼ�ϵ��ʹ�õĵ������Һ��KOH��Һ����װ����ͼ��ʾ��a�缫��ӦʽΪ________������ȼ�ϵ�����ı�״����6.72 L����(���������O2�������Ϊ20%)��������������NH3������Ϊ_______g��

��4���״�ȼ�ϵ��������Ӧ��Ҳ�ܹ㷺�����¶�Ϊ650���������ȼ�ϵ�����ü״���������CO2�Ļ����������Ӧ������缫����Li2CO3��Na2CO3�����������ʡ�д���õ�صĸ�����Ӧʽ______________��
����Ŀ��300��ʱ��������X������Y��0.16 mol����10 L�����ܱ������У�������Ӧ��X(g) +Y(g)![]() 2Z(g) ��H��0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g) ��H��0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
�ش��������⣺
��1����Ӧ0~2 min Z��ƽ������v(Z)=_____________
��2�����жϸ÷�Ӧ�Ѿ��ﵽƽ��״̬����_____________
A������X������������Z�����ʵ�2��
B��������ѹǿ���ֲ���
C��������������ܶȱ��ֲ���
D�������ڸ������Ũ�ȱ��ֲ���
��3��Ҫ���������Ӧ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____________����дһ�֣���
��4���¶�Ϊ300��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��_______________
��5������ʼʱ��������г���X��Y��Z��0.20 mol����Ӧ����____����������������������Ӧ������У���ƽ��ʱZ���������������ƽ�����______������������������С��������������