题目内容
18.已知R为短周期元素.在一定条件下,RO3n-与R2-发生如下反应:RO3n-+2R2-+6H+=3R+3H2O下列关于元素R的叙述中正确的是( )| A. | R原子的最外层上有4个电子 | |
| B. | RO3n-中的R只能被还原 | |
| C. | HnRO3一定是强酸 | |
| D. | R的单质既具有氧化性又具有还原性 |
分析 由电荷守恒可知,-n+2×(-2)+6×(+1)=0,n=2,RO3n-中元素R的化合价是+4价,R是短周期元素,R2-中元素R的化合价-2价,根据元素周期律,最低负价=主族序数-8,最高正价=其族序数,且有正化合价,所以R是S元素,结合含硫化合物的性质及原子结构来解答.
解答 解:由电荷守恒可知,-n+2×(-2)+6×(+1)=0,n=2,RO3n-中元素R的化合价是+4价,R是短周期元素,R2-中元素R的化合价-2价,根据元素周期律,最低负价=主族序数-8,最高正价=其族序数,且有正化合价,所以R是S元素,
A.最外层上有6个电子,故A错误;
B.RO3n-中元素R的化合价是+4价,中间价态既有氧化性又有还原性,故B错误;
C.R是S元素,亚硫酸是弱酸,故C错误;
D.S的单质化合价居于中间价,既具有氧化性又具有还原性,故D正确.
故选:D.
点评 本题考查氧化还原反应,为高频考点,把握电荷守恒及原子结构与化合价的关系为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
相关题目
8.下列实验装置能够达到目的是( )
| A. | 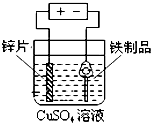 铁制品表面镀锌 | B. | 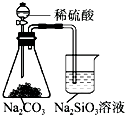 验证碳酸酸性强于硅酸 | ||
| C. | 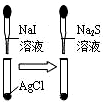 说明溶解性AgCl<AgI<Ag2S | D. |  浸在冷水中的玻璃球颜色较深 |
9.分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )
| A. | 8种 | B. | 16种 | C. | 32种 | D. | 64种 |
6.已知钫(Fr) 和砹(At)分别是碱金属元素和卤族元素中原子序数最大的元素,关于两者性质的预测,不正确的是( )
| A. | 钫与水反应发生爆炸,生成的氢氧化物FrOH是一种极强的碱 | |
| B. | 钫极易在氧气中燃烧,燃烧生成复杂的氧化物 | |
| C. | 砹单质是有色气体,易溶于CCl4等有机溶剂 | |
| D. | 砹单质不容易与氢气化合 |
13.下列对碱金属性质的叙述中,正确的是( )
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高.
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
3.以下实验或操作不能达到目的是( )
| A. | 用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸 | |
| B. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| C. | 用酸式滴定管量取8.00mL1mol/L的KMnO4溶液 | |
| D. | 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,必须重新配制 |
10.下列对“氢气和氧气反应生成水是放热反应”的理解合理的是( )
| A. | 反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| B. | 2 mol水的总能量高于2 mol氢气和1 mol氧气的总能量 | |
| C. | 断裂2 molH-H键和断裂1 molO═O键吸收的总能量低于形成4 molH-O键放出的总能量 | |
| D. | 断裂4 molH-O键吸收的总能量高于形成2 molH-H键和形成1 molO═O键放出的总能量 |
7.有8种物质:①乙烷;②乙烯;④苯;⑤甲苯;⑥溴乙烷;⑦聚乙烯;⑧环己烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应而使溴水褪色的是(( )
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
8.取1 mol A和a mol B使其发生反应 A(g)+aB(g)?bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的$\frac{4}{3}$倍,则a、b可能是( )
| A. | a=1,b=4 | B. | a=3,b=3 | C. | a=2,b=3 | D. | a=3,b=2 |