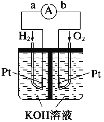
��Ŀ����
����Ŀ��PbCl2��һ����Ҫ�Ļ������ϣ����������ܼ����Ʊ�Ǧ�Ƶ�Ⱦ�ϡ���ҵ���������÷�Ǧ����Ҫ�ɷ�ΪPbS������FeS2�����ʣ������̿���Ҫ�ɷ�ΪMnO2���Ʊ�PbCl2�Ĺ�����������ͼ��ʾ��
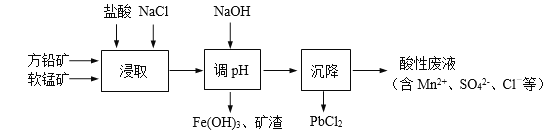
��֪��i. PbCl2����ˮ
ii. PbCl2 (s) + 2Cl��(aq) ![]() PbCl42-(aq) ��H > 0
PbCl42-(aq) ��H > 0
��1���ڽ�ȡǰ��ʯ��ƷҪ���飬Ŀ����___________��
��2����ȡ������MnO2��PbS�������·�Ӧ���뽫���ӷ�Ӧ����ʽ��ƽ��
__+__+PbS+__MnO2=PbCl2+______+_______+__
��3������PbCl2����ˮ���������ڷ�Ǧ������γ����ۻ�����ʹ��Ӧ���ʴ�ͣ���ȡ���м��뱥��NaCl��Һ����Ч������һ����ԭ����_______________��
��4������pH��Ŀ����_________________��
��5������pH���˺����Һ��������أ�����Һ�л��PbCl2(s)���Բ�ȡ�Ĵ�ʩ��_________��
���𰸡�����Ӧ��Ӵ��������߷�Ӧ���� 8H�� 2Cl�� 4 4Mn2+ SO42�� 4H2O PbCl2 (s) + 2Cl��(aq) ![]() PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ������� ��ȥ��Һ�е�Fe3+ ��ˮϡ�͡�����
PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ������� ��ȥ��Һ�е�Fe3+ ��ˮϡ�͡�����
��������
��Ǧ����Ҫ�ɷ�ΪPbS������FeS2�����ʣ������̿���Ҫ�ɷ�ΪMnO2���м���ϡ���ᣬ�������Է�Һ�к�����������ӿ�֪PbS��SԪ�ر���������������ӣ������Ȼ��ƴٽ���ӦPbCl2(s) + 2Cl��(aq)![]() PbCl42�� (aq)�������������Ƶ���pH��ʹ������ת��Ϊ�����������������˵õ�������������������Һ��PbCl2����ˮ������Һ�������˵õ�PbCl2���ݴ˽��
PbCl42�� (aq)�������������Ƶ���pH��ʹ������ת��Ϊ�����������������˵õ�������������������Һ��PbCl2����ˮ������Һ�������˵õ�PbCl2���ݴ˽��
��1���ڽ�ȡǰ��ʯ��ƷҪ���飬Ŀ��������Ӧ��Ӵ��������߷�Ӧ���ʣ��ʴ�Ϊ������Ӧ��Ӵ��������߷�Ӧ���ʡ�
��2����ȡ������MnO2��PbS������Ӧ4MnO2+ PbS+8HCl=3MnCl2+ PbCl2+MnSO4+4H2O�����ӷ���ʽΪ8H++2Cl-+4MnO2+ PbS= PbCl2+4Mn2++ SO42-+4H2O���ʴ�Ϊ��8H����2Cl����4 ��4Mn2+ ��SO42���� 4H2O��
��3����ȡ���м��뱥��NaCl��Һ����Ч������һ����ԭ����PbCl2 (s) + 2Cl��(aq) ![]() PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱���ʴ�Ϊ��PbCl2 (s) + 2Cl��(aq)
PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱���ʴ�Ϊ��PbCl2 (s) + 2Cl��(aq) ![]() PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱��
PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱��
��4���������̿�֪��������Һ��pH,ʹ������ת��Ϊ��������������ȥ��Һ�е�Fe3+���ʴ�Ϊ����ȥ��Һ�е�Fe3+��
��5����֪PbCl2(s) + 2Cl��(aq)![]() PbCl42-(aq) ��H��0����ͨ����ˮϡ�ͣ����´ٽ���Ӧ������У����PbCl2���ʴ�Ϊ����ˮϡ�͡����¡�
PbCl42-(aq) ��H��0����ͨ����ˮϡ�ͣ����´ٽ���Ӧ������У����PbCl2���ʴ�Ϊ����ˮϡ�͡����¡�

 ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�����Ŀ���������ȣ�ClO2���㷺Ӧ����ֽ��Ư�ס�ɱ��������ˮ��������������ҵ�����ü״���ԭNaClO3�ķ����Ʊ�ClO2�������������£�
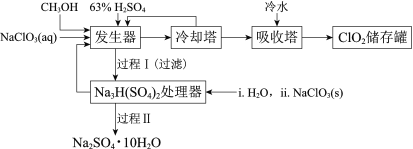
��֪��a�����������Ʊ�ClO2�ķ�Ӧ��12NaClO3+8H2SO4+3CH3OH= 12ClO2��+3HCOOH+4Na3H(SO4)2��+9H2O
b��������ʵ��۷е㣺
���� | CH3OH | HCOOH | ClO2 |
�۵�/�� | ��97 | 9 | ��59 |
�е�/�� | 65 | 101 | 11 |
(1)ClO2������ֽ��Ư�ס�ɱ���������������______�ԡ�
(2)��ȴ�����ڷ���ClO2������CH3OH��Ӧ���Ƶ�����¶�Ϊ______������ĸ����
A��0~10�� B��20~30�� C��60~70��
(3)�����̢���̢���Ի��â����Na2SO4��10H2O����ʹ����ԭ��ѭ�����á�
��֪��Na2SO4��10H2O��Na2SO4���ܽ����������ͼ��
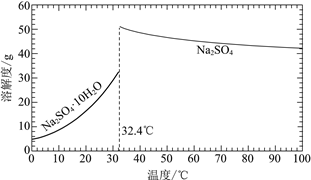
��Na3H(SO4)2�������л��â��ʱ�����NaClO3���壬��â���ܽ�ƽ��ĽǶȽ�����ԭ��______��
�ڽ��Na2SO4��10H2O��Na2SO4���ܽ�����ߣ����̢�IJ����ǣ���32.4�����������______��
��Na3H(SO4)2����������Һ�п���ѭ�����õ�ԭ����NaClO3��______��