题目内容
【题目】下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
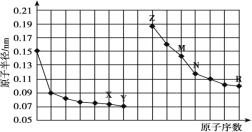
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
【答案】C
【解析】
同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可以知道X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素。
A.同周期元素从左到右元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物对应水化物的碱性越强,所以碱性强弱为:Z>M,A错误;
B.X、N两种元素组成的化合物为二氧化硅,二氧化硅是由原子组成,属于共价化合物,B错误;
C.气态氢化物的稳定性和非金属性有关,非金属性越强,气态氢化物越稳定,非金属性Y>R,Y、R 两种元素气态氢化物的稳定性:Y>R,C正确;
D.离子电子层结构相同,核电荷数越大,离子半径越小,所以简单离子的半径:M<Z<X,D错误;
故选C。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】I.反应![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率= ______ 。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 ______
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
II.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇: CO(g)+2H2(g)CH3OH(g)。请根据图示回答下列问题:
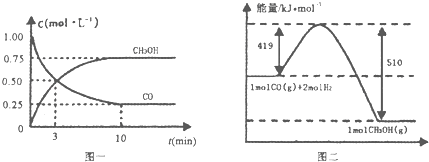
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ______ 。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
乙 | 1molCH3OH | a2 | c2 | 吸收Q2kJ热量 |
丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是 ______ .
A c1=c2 B 2Q1=Q3 C 2a1=a3 D a1+a2=1 E 该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量。