题目内容
9.将CH4跟Cl2混合,日光漫射,假设生成的4种氯代物的物质的量相等,则混合气体中CH4跟Cl2的物质的量比为( )| A. | 1:4 | B. | 2:3 | C. | 1:7 | D. | 2:5 |
分析 甲烷和氯气发生取代反应生成四种取代物的方程式分别为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl、CH4+2Cl2$\stackrel{光照}{→}$CH2Cl2+2HCl、CH4+3Cl2$\stackrel{光照}{→}$CHCl3+3HCl、CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,假设生成的4种氯代物的物质的量相等,根据方程式计算甲烷和氯气的物质的量之比.
解答 解:甲烷和氯气发生取代反应生成四种取代物的方程式分别为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl、CH4+2Cl2$\stackrel{光照}{→}$CH2Cl2+2HCl、CH4+3Cl2$\stackrel{光照}{→}$CHCl3+3HCl、CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,假设生成的4种氯代物的物质的量相等,假设四种氯代物的物质的量都是1mol,则需要氯气的物质的量=(1+2+3+4)mol=10mol,则甲烷和氯气的物质的量之比=4mol:10mol=2:5,故选D.
点评 本题考查化学方程式的有关计算,为高频考点,明确取代反应特点是解本题关键,结合方程式分析解答,题目难度不大.

练习册系列答案
相关题目
20.下列物质分别与NaOH的醇溶液共热后,能发生消去反应,且生成的有机物不存在同分异构体的是( )
| A. | 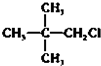 | B. |  | C. | CH3Cl | D. | 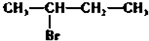 |
17.表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号);
(2)表中元素⑤的原子结构示意图是 ;
;
(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填化学式);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4(填化学式);
(5)表中元素②的最高价氧化物属于两性氧化物(选填“酸性氧化物、两性氧化物、碱性氧化物”).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | |||
| 三 | ⑦ | ⑧ | ② | ⑨ | ⑩ | ||
| 四 | ⑪ | ⑫ | |||||
(2)表中元素⑤的原子结构示意图是
 ;
;(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填化学式);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4(填化学式);
(5)表中元素②的最高价氧化物属于两性氧化物(选填“酸性氧化物、两性氧化物、碱性氧化物”).
4. 实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为ClO-+2I-+2H+═Cl-+I2+H2O.
②NaClO溶液的物质的量浓度是0.1060 mol•L -1.
 实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
②NaClO溶液的物质的量浓度是0.1060 mol•L -1.
14.下列物质常温下能与溴水发生取代反应的是( )
| A. | 苯酚 | B. | 苯乙烯(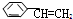 ) ) | C. | 苯 | D. | 苯甲醇(  ) ) |
1.把200mL含有CaCl2和KCl的混合溶液分成2等份,取一份加入含2a mol 碳酸钠的溶液,恰好使钙离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-4a) mol•L-1 | B. | 0.1(b-2a) mol•L-1 | C. | 10(b-4a) mol•L-1 | D. | 10(b-2a) mol•L-1 |
18.下列说法不正确的是( )
| A. | 废旧电池应集中回收处理 | |
| B. | 充电电池放电时,化学能转变为电能 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
19.一定温度下,在带活塞的密闭容器中,反应H2(g)+I2(g)?2HI(g)(正反应为放热反应)达到平衡后,下列说法中不正确的是( )
| A. | 恒压时,通入HI气体,刚开始时正反应速率会减小 | |
| B. | 恒温时,减小容积,平衡不移动,但气体颜色加深 | |
| C. | 恒容时,通入H2,I2的质量分数减小 | |
| D. | 恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小 |