题目内容
17.表为元素周期表的一部分.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | |||
| 三 | ⑦ | ⑧ | ② | ⑨ | ⑩ | ||
| 四 | ⑪ | ⑫ | |||||
(2)表中元素⑤的原子结构示意图是
 ;
;(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填化学式);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4(填化学式);
(5)表中元素②的最高价氧化物属于两性氧化物(选填“酸性氧化物、两性氧化物、碱性氧化物”).
分析 由元素在周期表中的位置可知,①为H、②为Al、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl、⑪为K、⑫为Br.
(1)同周期自左而右元素金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,上述元素单质中溴的单质常温下为液态;
(2)元素⑤为O元素,原子核外有8个电子,有个电子层,各层电子数为2、6;
(3)元素非金属性越强,对应氢化物越稳定;
(4)元素非金属性越强,最高价含氧酸的酸性越强;
(5)元素②的最高价氧化物为氧化铝,属于两性氧化物.
解答 解:由元素在周期表中的位置可知,①为H、②为Al、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl、⑪为K、⑫为Br.
(1)同周期自左而右元素金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中F元素非金属性最强,K的金属性最强,上述元素单质中溴的单质常温下为液态,
故答案为:F;K;Br;
(2)元素⑤为O元素,原子核外有8个电子,有个电子层,各层电子数为2、6,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)非金属性F>Cl>S,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:HF>HCl>H2S,
故答案为:HF>HCl>H2S;
(4)非金属性Cl>S,元素非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,
故答案为:HClO4>H2SO4;
(5)元素②的最高价氧化物为氧化铝,与酸、碱反应均可以得到盐与水,属于两性氧化物,
故答案为:两性氧化物.
点评 本题考查元素周期表与元素周期律,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
16.在试管的内壁附着下列物质,用稀盐酸浸泡而不能除去的是( )
| A. | 用足量一氧化碳还原氧化铁后留下的物质 | |
| B. | 硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体 | |
| C. | 盛石灰水后留下的白色固体 | |
| D. | 用足量氢气还原氧化铜后留下的红色物质 |
5.下列各项表达中正确的是( )
| A. | Na2O2的电子式为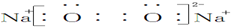 | B. | H2S2的结构式:H-S-S-H | ||
| C. | 原子核内有8个中子的碳原子148C | D. | NH4Cl的电子式: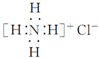 |
12.下列说法中正确的是( )
| A. | 元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化 | |
| B. | 元素性质的周期性变化决定于元素原子结构的周期性变化 | |
| C. | 从Li→F,Na→Cl,元素的最高化合价均呈现从+1价→+7价的变化 | |
| D. | 电子总是尽量先排在能量较低的电子层,如排满了K层排L层,排满了M层排N层 |
2.下列说法正确的是( )
| A. | 石油是烃的衍生物的混合物 | |
| B. | 核磁共振(1H-NMR)、红外光谱、质谱法等都是现代化学测定有机化合物结构的分析方法 | |
| C. | 有机物都易溶于有机溶剂,且熔、沸点低,容易燃烧,受热易分解 | |
| D. | 蛋白质溶液中加入重金属盐能够降低蛋白质的溶解性,使蛋白质转变为沉淀析出 |
9.将CH4跟Cl2混合,日光漫射,假设生成的4种氯代物的物质的量相等,则混合气体中CH4跟Cl2的物质的量比为( )
| A. | 1:4 | B. | 2:3 | C. | 1:7 | D. | 2:5 |
7.一定温度下,在体积可变的恒温密闭容器中,甲醇在浓硫酸作催化剂的条件下发生下列反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列有关该反应的叙述正确的是( )
| A. | 该条件下,1 mol CH3OH(g)参加反应,放出的热量为25 kJ | |
| B. | 若不采用合适的催化剂,该反应中甲醇的转化率将降低 | |
| C. | 升高温度和增大压强(缩小容器容积)均可加快反应速率 | |
| D. | 反应过程中,2v(CH3OH)=v(CH3OCH3) |
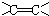 碳碳双键
碳碳双键  羰基
羰基 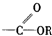 酯基.
酯基.