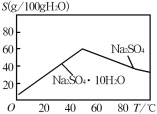
题目内容
【题目】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
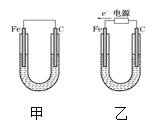
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___棒,乙装置中的____棒;
②乙装置的电化学防护法称为____,其中碳极的电极反应式是:_____。
③取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为___,发生反应的离子方程式为________
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______。
②甲装置碳极的电极反应属于_____(填“氧化反应”或“还原反应”);
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因_____
(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是(_____)
A.KI B.H2SO4 C.CuCl2 D.AgNO3
【答案】碳 铁 外加电流的阴极保护法 2H2O-4e-=O2↑+4H+ 产生蓝色沉淀 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 还原反应 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 B
Cl2↑+H2↑+2OH- 还原反应 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 B
【解析】
(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
②外加电源,铁在阴极,属于外加电流的阴极保护法,碳极是阳极,失电子发生氧化反应;
③用K3[Fe(CN)6]溶液检验亚铁离子。
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,正极上发生得电子的还原反应;
③氯气具有强氧化性,能将碘离子氧化生成碘单质,碘遇淀粉试液变蓝色。
(3)电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同,应为电解水型的电解,电解时阳极反应为:4OH--4e-=2H2O+O2↑,阴极反应为:4H++4e-=2H2↑,可为电解含氧酸溶液、强碱溶液或活泼金属的含氧酸盐溶液。
(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu;
②外加电源,铁在阴极,乙装置的电化学防护法称为外加电流的阴极保护法,碳极是阳极,根据放电顺序,水电离的OH-失电子发生氧化反应,碳极的电极反应式是:2H2O-4e-=O2↑+4H+。
③甲装置中Fe为负极,Fe失电子生成Fe2+,取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为产生蓝色沉淀,发生反应的离子方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓。
(2)①Fe为阴极,C为阳极,电解NaCl溶液生成NaOH、氢气、氯气,离子反应方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH- ;
Cl2↑+H2↑+2OH- ;
②甲中碳为正极,正极上氧气得电子发生还原反应,电极反应为2H2O+O2+4e-═4OH-;
③碳电极为阳极,阳极上Cl-失电子生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,故原因为:在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝。
(3)A.电解KI溶液,生成KOH、H2、I2,加水显然不能恢复电解前的状态,应通入适量的HI气体,故A错误。
B.电解硫酸,阳极生成氧气,阴极生成氢气,实际为电解水,电解后加入水可恢复到原来的浓度,故B正确;
C.电解CuCl2,阳极生成氯气,阴极生成Cu,实际为电解氯化铜本身,电解后加入氯化铜恢复到原来的浓度,故C错误;
D.电解AgNO3,阳极析出O2,阴极生成Ag,要使溶液恢复到原来的浓度,应加入Ag2O,故D错误;
故选B。

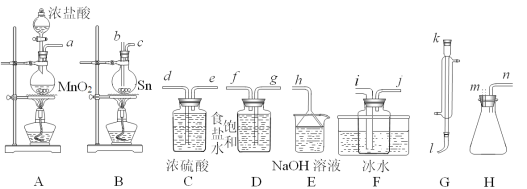
【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。
SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。