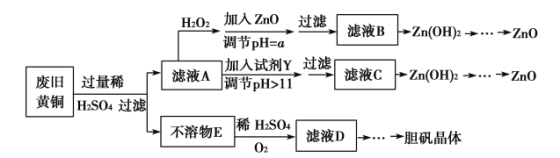
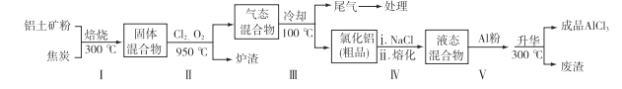
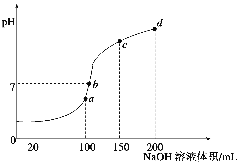
��Ŀ����
����Ŀ������ Y ��������������Ͽ��Խ�������ʵ�飨�̶�װ���ԣ����������ش��������⣺
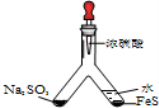
��1�� |
| ʵ��Ŀ�ģ���֤SO2�������� ����ͷ�ι���Ũ����ֱ����Y�ܵ�����֧���У���֧�ܽ��洦ʵ������Ϊ_____________�� ����������ˮ��Ŀ����_________________�� |
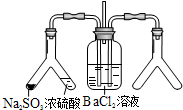
��2�� |
| ʵ��Ŀ�ģ�̽��SO2��BaCl2��Ӧ�������������� ��������ͨ���Ȼ�����Һ����������������ͨ����һ���������Բ�����ɫ���������Ҳ�Y����Ӧ���õ�ҩƷ��______����Ҫʱ���Լ��ȣ����ó����Ļ�ѧʽΪ_______________�� |
��4�� |
| ʵ��Ŀ�ģ�п���Ͻ����������IJⶨ ����ȡ������������ʱ��������ˮ���е�Һ�������������Һ�棬Ӧ��ȡ�Ĵ�ʩ��___________�� �����Ƶ�п���Ͻ������Ϊ0.117g���������г�����Ϊ1.00mL��ĩ����Ϊ45.80mL����Ͻ������ĺ���Ϊ_______%������2λС���������������� |
���𰸡���1���ܱ����е���ɫ�������ɣ�ϡ��Ũ���ᣬ��ֹ���ⱻ��������2��Ũ�� ˮ����ʯ��(���� NaOH����ʯ��)�������ᱵ����������ͭƬ��Ũ������ᱵ����������3����̧�ߣ����ƶ���ˮ��λ�ã�ʹˮ�ܡ���������Һ����ƽ�� ��69.14%��
��������
�����������1����������ֱ�����SO2��H2S�����߿ɷ�����Ӧ����S��Ϊ����ɫ���壬H2S����ǿ��ԭ�ԣ�������������������ԣ��������Ũ���ᷢ��������ԭ��Ӧ����������FeS��һ��Ӧ��ˮϡ�ͣ�
��2��SO2��BaCl2��Ӧ������������Һ�б�����ڴ�����SO32-���Ҳ�Y����Ӧ�����ɼ�����������������壬���Ǽ������壬��Һ�д��ڴ�����SO32-���������������壬��Һ�п�����SO42-�������ɵij�������ΪBaSO3��BaSO4������Ǽ������就����������Ũ��ˮ����ʯ�ң�����NaOH����ʯ�ң���ȡ�����ɵij�����BaSO3��
��3������ȡ������������ʱ��Ϊ��С��Ӧʹˮ�ܡ���������Һ����ƽ������Ͻ���FeΪxmol��ZnΪymol������ 56x+65y=0.117��x+y=0.0448L��22.4L/mol=0.002mol����ã�x=0.001444��y=0.000556����Ͻ������ĺ���Ϊ0.001444��56/0.117=69.14%��