题目内容
【题目】业废渣、废水回收利用是重要研究课题。下面流程是生产食用香料正丁酸乙酯的工厂废水(含乙醇、正丁酸乙酯、正丁酸、乙醚和大量无机悬浮物)联合利用电子工业废料[含SiO2和Cu2(OH)2CO3]回收铜的工艺设计。回答下列问题:
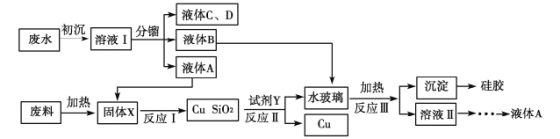
(1)初沉加入的试剂是明矾,写出参与净水的离子的水解方程式:________________________。
(2)固体X的成分是__________,反应Ⅰ的化学反应方程式____________________。
(3)试剂Y为__________,加快反应Ⅱ速率的措施有__________________(任写一条)。
(4)反应Ⅲ的离子方程式为______________________。
(5)硅胶在生活与生产中用途广泛,写出其中一种用途:________________________。
【答案】(1)Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
(2)CuO SiO2 CH3CH2OH+CuOCH3CHO+H2O+Cu
(3)氢氧化钠溶液 增大氢氧化钠溶液的浓度、将固体粉碎(或升高温度等合理答案)
(4)2CH3CH2CH2COOCH2CH3+SiO![]() +2H2O2CH3CH2CH2COO-+2CH3CH2OH+H2SiO3↓
+2H2O2CH3CH2CH2COO-+2CH3CH2OH+H2SiO3↓
(5)催化剂载体(或干燥剂)
【解析】液体A、B、C、D为分馏产物,根据沸点不同得到分离。分子晶体的熔沸点与相对分子质量大小有关,正丁酸、乙醚相对分子质量最接近难以分开,所以液体C和D的混合物应该是正丁酸、乙醚的混合物。
(1)明矾净水在于Al3+的水解:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(2)废料[含SiO2和Cu2(OH)2CO3]加热情况下发生的化学反应方程式为:Cu2(OH)2CO32CuO+H2O+CO2↑则固体X的成分是CuO、SiO2。能与CuO反应的为乙醇和正丁酸,由于正丁酸在液体C和D的混合物中,所以液体A为乙醇。反应Ⅰ的化学反应方程式:CH3CH2OH+CuOCH3CHO+H2O+Cu。
(3)试剂Y是氢氧化钠溶液;增大氢氧化钠溶液(试剂B)的浓度、将固体粉碎、升高温度等。
(4)液体B为正丁酸乙酯,反应方程式为:2CH3CH2CH2COOCH2CH3+SiO![]() +2H2O2CH3CH2CH2COO-+2CH3CH2OH+H2SiO3↓。
+2H2O2CH3CH2CH2COO-+2CH3CH2OH+H2SiO3↓。
(5)硅胶的用途:催化剂载体(或干燥剂)。

【题目】下列各组物质中,分类完全正确的一组是( )
A酸 | B碱 | C盐 | D氧化物 |
H2SO4 | Ba(OH)2 | H2S | H2O2 |
NaHCO3 | Cu2(OH)2CO3 | KCl | CO |
HNO3 | NaOH | CaCO3 | CuO |
HCl | Na2CO3 | CuSO4 | MnO2 |
A.A
B.B
C.C
D.D