题目内容
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
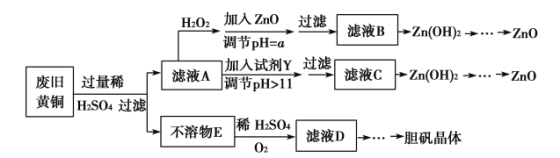
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________________,a的范围________________________。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为________________________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是__________________________
(5)下列试剂可作为Y试剂的是____________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________。
【答案】(1)使溶液中的Fe3+完全沉淀,Zn2+不被沉淀(其他解释合理即可) 3.0≤a<5.9
(2)2Cu+O2+2H2SO4===2CuSO4+2H2O
(3)2Fe2++H2O2+2H+===2Fe3++2H2O
(4)蒸发浓缩、冷却结晶、过滤
(5)B 先产生白色沉淀后沉淀溶解
【解析】(1)加入ZnO调节pH=a的目的是使溶液中的Fe3+完全沉淀,Zn2+不被沉淀,a范围的选择是3.0≤a<5.9。
(2)由不溶物E生成溶液D的化学方程式为2Cu+O2+2H2SO4===2CuSO4+2H2O。
(3)滤液A中含有亚铁离子,加入H2O2反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。
(4)由硫酸铜溶液制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、过滤。
(5)因为pH>11,Y试剂的目的是让Zn(OH)2全部生成[Zn(OH)4]2-,所以Y试剂选用NaOH,滤液C的主要成分是[Zn(OH)4]2-,逐滴加入盐酸直到过量,跟AlO![]() 溶液中逐滴加入盐酸直到过量进行类推,所以产生的现象是先产生白色沉淀后溶解。
溶液中逐滴加入盐酸直到过量进行类推,所以产生的现象是先产生白色沉淀后溶解。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各组物质中,分类完全正确的一组是( )
A酸 | B碱 | C盐 | D氧化物 |
H2SO4 | Ba(OH)2 | H2S | H2O2 |
NaHCO3 | Cu2(OH)2CO3 | KCl | CO |
HNO3 | NaOH | CaCO3 | CuO |
HCl | Na2CO3 | CuSO4 | MnO2 |
A.A
B.B
C.C
D.D