题目内容
【题目】TiO2和TiCl4均为重要的工业原料。已知:
Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH2= -220.9kJ·mol-1
2CO(g) ΔH2= -220.9kJ·mol-1
请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成TiO2(s)、C(s)和氯气的热化学方程式为_____________________。升高温度,对该反应的影响为___________________________________。
(2)若反应Ⅱ的逆反应活化能表示为EkJ·mol-1,则E________220.9(填“>”“<”或“=”)。
(3)t℃时,向10 L恒容密闭容器中充入1molTiCl4和2 molO2,发生反应Ⅰ。5min达到平衡时测得TiO2的物质的量为0.2 mol。
①0~5 min 内,用Cl2表示的反应速率v(Cl2)=__________。
②TiCl4的平衡转化率a=__________________。
③下列措施,既能加快逆反应速率又能增大TiCl4的平衡转化率的是__________(填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大O2浓度
④t℃时,向10 L恒容密闭容器中充入3 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(a)与起始的物质的量之比(![]() )的关系如图所示:
)的关系如图所示:
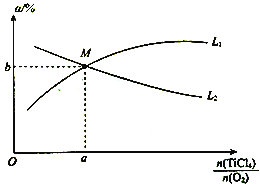
能表示TiCl4平衡转化率的曲线为__________(填“L1”或“L2”);M点的坐标为___________。
【答案】 TiCl4(g)+2CO(g)=TiO2(s)+2Cl2(g)+2C(s) ΔH=+45.5kJ·mol-1 反应速率加快,平衡正向移动,反应物的转化率增大 > 0.008 mol·L-1·min-1 20% D L2 (1, ![]() )
)
【解析】(1)已知:Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH1=-175.4 kJ·mol-1
TiO2(s)+2Cl2(g) ΔH1=-175.4 kJ·mol-1
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH2= -220.9kJ·mol-1 ,用Ⅰ-Ⅱ,TiCl4(g)+2CO(g)=TiO2(s)+2Cl2(g)+2C(s) ΔH=-175.4 kJ·mol-1-(-220.9kJ·mol-1)=+45.5kJ·mol-1 ;升高温度,反应速率加快,平衡正向移动,反应物的转化率增大;(2)若反应Ⅱ的逆反应活化能表示为E kJ·mol-1,正反应是放热反应,则E>220.9kJ·mol-1;(3)①0~5 min 内,用Cl2表示的反应速率v(Cl2)=2v(TiCl4)=2×0.2mol/(10L×5min)=0.008 mol·L-1·min-1 ;②TiCl4的平衡转化率a=0.2mol/1mol×100%=20%;③A、缩小容器容积,反应速率加快,平衡逆向移动,故A错误; B.加入催化剂平衡不移动,故B错误;C.分离出部分TiO2 速率变慢,故C错误;D.增大O2浓度既能加快逆反应速率又能增大TiCl4的平衡转化率,故D正确;故选D。④随TiCl4浓度的增加,TiCl4转化率越来越小,能表示TiCl4平衡转化率的曲线为L2;M点表示n(TiCl4)/n(O2)=方程式的计量数比=1时,TiCl4的转化率与O2的转化率相同,即a=1;由t℃时,向10 L恒容密闭容器中充入1molTiCl4和2 molO2,发生反应Ⅰ。5min达到平衡时测得TiO2的物质的量为0.2 mol。平衡时四种物质的浓度分别为0.08mol·L-1TiCl4、0.18mol·L-1O2,0.04mol·L-1Cl2,平衡常数K=
2CO(g) ΔH2= -220.9kJ·mol-1 ,用Ⅰ-Ⅱ,TiCl4(g)+2CO(g)=TiO2(s)+2Cl2(g)+2C(s) ΔH=-175.4 kJ·mol-1-(-220.9kJ·mol-1)=+45.5kJ·mol-1 ;升高温度,反应速率加快,平衡正向移动,反应物的转化率增大;(2)若反应Ⅱ的逆反应活化能表示为E kJ·mol-1,正反应是放热反应,则E>220.9kJ·mol-1;(3)①0~5 min 内,用Cl2表示的反应速率v(Cl2)=2v(TiCl4)=2×0.2mol/(10L×5min)=0.008 mol·L-1·min-1 ;②TiCl4的平衡转化率a=0.2mol/1mol×100%=20%;③A、缩小容器容积,反应速率加快,平衡逆向移动,故A错误; B.加入催化剂平衡不移动,故B错误;C.分离出部分TiO2 速率变慢,故C错误;D.增大O2浓度既能加快逆反应速率又能增大TiCl4的平衡转化率,故D正确;故选D。④随TiCl4浓度的增加,TiCl4转化率越来越小,能表示TiCl4平衡转化率的曲线为L2;M点表示n(TiCl4)/n(O2)=方程式的计量数比=1时,TiCl4的转化率与O2的转化率相同,即a=1;由t℃时,向10 L恒容密闭容器中充入1molTiCl4和2 molO2,发生反应Ⅰ。5min达到平衡时测得TiO2的物质的量为0.2 mol。平衡时四种物质的浓度分别为0.08mol·L-1TiCl4、0.18mol·L-1O2,0.04mol·L-1Cl2,平衡常数K=![]() ;t℃时,向10 L恒容密闭容器中充入3 mol TiCl4和3 molO2的混合气体时,n(TiCl4)/n(O2)=方程式的计量数比,M点两物质的转化率相等,令转化率为x,则平衡时四种物质的浓度分别为:0.3(1-x)mol·L-1TiCl4、0.3(1-x)mol·L-1O2,0.6xmol·L-1Cl2,温度不变,平衡常数不变,
;t℃时,向10 L恒容密闭容器中充入3 mol TiCl4和3 molO2的混合气体时,n(TiCl4)/n(O2)=方程式的计量数比,M点两物质的转化率相等,令转化率为x,则平衡时四种物质的浓度分别为:0.3(1-x)mol·L-1TiCl4、0.3(1-x)mol·L-1O2,0.6xmol·L-1Cl2,温度不变,平衡常数不变, 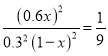 ,解得x=1/7.
,解得x=1/7.