题目内容
【题目】有机物F用于制造香精,可利用下列路线合成。回答下列问题:
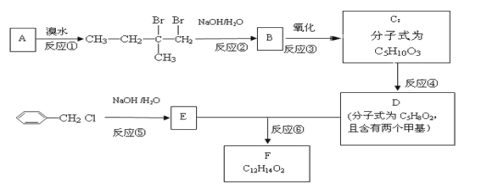
(1)A的化学名称是___。
(2)B的结构简式是___。
(3)①~⑥中属于取代反应的有___(填序号)。
(4)反应⑥的化学方程式为___。
(5)C有多种同分异构体,与C具有相同官能团的有__种(不包括C),其中核磁共振氢谱为四组峰的结构简式为___(任写一种)。
【答案】2-甲基-1-丁烯 CH3CH2C(CH3)OHCH2OH ②⑤⑥ 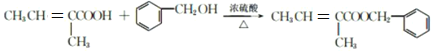 +H2O 11
+H2O 11 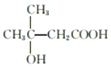
【解析】
根据框图和各物质之间的反应条件可推知:由反应①的产物可推知A是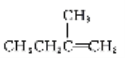 ;B是
;B是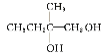 ,C是
,C是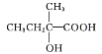 ,D是
,D是![]() ,E是
,E是![]() ,F是
,F是 。
。
(1)由上述分析可知A的结构简式为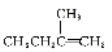 ,其化学名称是2-甲基-1-丁烯,故答案为:2-甲基-1-丁烯;
,其化学名称是2-甲基-1-丁烯,故答案为:2-甲基-1-丁烯;
(2)由上述分析可知B的结构简式是CH3CH2C(CH3)OHCH2OH;
(3)根据产物和反应条件知①为加成反应,②为卤代烃的取代反应,③氧化反应,④为消去反应,⑤为取代反应,⑥酯化反应。其中属于取代反应的有②⑤⑥;答案:②⑤⑥。
(4)E为苯甲醇,D是![]() ,反应⑥是E和D发生的酯化反应,其化学方程式为
,反应⑥是E和D发生的酯化反应,其化学方程式为 +H2O。
+H2O。
(5)C是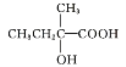 ,C中含有羟基和羧基,与C具有相同官能团的同分异构体有:
,C中含有羟基和羧基,与C具有相同官能团的同分异构体有:![]() (移动-OH位置共有4种),
(移动-OH位置共有4种),![]() (移动-OH位置共有3种)
(移动-OH位置共有3种)![]() (移动-OH位置共有3种),
(移动-OH位置共有3种),![]() (1种),所以符合条件的同分异构体共11种(不包括C),其中核磁共振氢谱为四组峰的结构简式可以为
(1种),所以符合条件的同分异构体共11种(不包括C),其中核磁共振氢谱为四组峰的结构简式可以为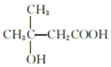 。
。

 备战中考寒假系列答案
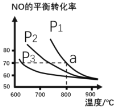
备战中考寒假系列答案【题目】活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是
活性炭/mol | NO/mol | X/mol | Y/mol | |
起始时 | 2.030 | 0.100 | 0 | 0 |
10min达平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
A. X一定是N2,Y一定是CO2
B. 10min后增大压强,NO的吸收率增大
C. 10min后加入活性炭,平衡向正反应方向移动
D. 0~10min的平均反应速率v(NO)=0.002 mol/(Lmin)
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
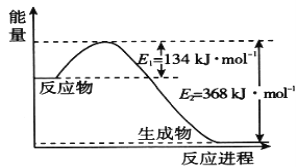
(1)如图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _________________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1 ______ K2(填“>”、“=” 或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2) = v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
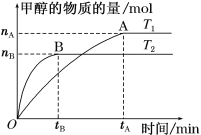
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填“>”、“=” 或“<”)。
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
(2)平衡后,若提高H2的转化率,可以采取的措施有__________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1__________K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是__________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益