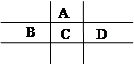题目内容
(12分)根据下列某些短周期元素中元素性质回答问题。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | | +3 | +4 | +5 | +7 | +1 | +5 | |
| 最低价态 | -1 | | -2 | | -4 | -3 | -1 | | -3 | -1 |
(2)元素①和⑨形成阳离子 ,其结构式为__________________。
(3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。
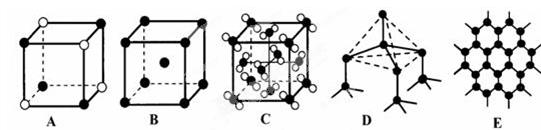
(4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。
(5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。
(1)H2O、NH3、PH3; (2)  (3)
(3)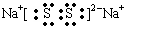 (4) A
(4) A
(5) NH4+ + H2O  NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)
NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(15分)(1)碳、氮、氧的第一电离能大小顺序为 ,氧原子电子排布式为 。
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。



(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来

(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。
(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
| 物质 | H2 | N2H4 | H2NN(CH3)2 |
| 沸点/℃ | -252.8 | 113.5 | ~116 |

回答下列问题:
①计算晶胞中含有几个水分子。 ②计算冰的密度。
(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
| R | 有多种化合价,其最高正价为+6价 |
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。
(2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。
(8分)(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素(3)元素在元素周期表中的位置与元素原子结构的关系_______________________ 。
氯化溴(BrCl)结构和性质类似Br2、Cl2。下列叙述正确的是
| A.BrCl是离子化合物 | B.Br-Cl键长大于Cl-Cl键长 |
| C.BrCl 和Br2中都存在极性键 | D.BrCl和Cl2都是非极性分子 |

 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。