题目内容
11.下列叙述正确的是( )| A. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| B. | 检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色.该实验说明FeCl3与KI反应有一定的限度 | |
| D. | 铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
分析 A.为防止玻璃塞和旋塞脱落,导致实验失败,当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞;
B.检验氨气,选择红色石蕊试纸;
C.溶液呈蓝色,说明有碘生成;向另一份溶液中滴加KSCN溶液,溶液呈血红色,说明还有未反应的Fe3+.该实验说明FeCl3与KI反应有一定的限度;
D.亚铁离子和铁氰化钾溶液反应生成蓝色沉淀.
解答 解:A.为防止玻璃塞和旋塞脱落,导致实验失败,当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡,故A正确;
B.将湿润的红色石蕊试纸靠近瓶口或管口,观察试纸是否变蓝色,检验氨气,故B错误;
C.向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色,说明有碘生成;向另一份溶液中滴加KSCN溶液,溶液呈血红色,说明还有未反应的Fe3+.该实验说明FeCl3与KI反应有一定的限度,故C正确;
D.Fe与醋酸反应生成亚铁离子,而亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,故D错误;
故选AC.
点评 本题考查物质的性质及检验等,为高频考点,综合考查元素化合物知识,把握性质、现象、反应的关系为解答的关键,侧重分析与应用能力的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2 L N2含有的原子数为NA | |
| B. | 32 g O2在标准状况下所占体积约为22.4 L | |
| C. | 标准状况下,18 g H2O所占的体积约为22.4 L | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
2.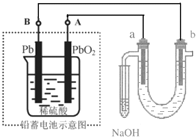 用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
 用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池放电时的正极反应是:PbO2+4H++SO42-═PbSO4+2H2O | |
| B. | 电解苦卤水时,a 电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- | |
| C. | 铅蓄电池充电时,A极应与外接电源负极相连 | |
| D. | 忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 molH2SO4 |