题目内容
3.下列各组离子在指定溶液中一定能大量共存的是( )①pH=0的溶液:Na+、C2O42-、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol•L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-.
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④ | D. | ①②④ |
分析 ①pH=0的溶液呈酸性,强氧化性物质和强还原性离子不能共存;
②pH=11的溶液呈碱性,离子之间不反应的能大量共存;
③水电离的H+浓度为10-12mol•L-1的溶液呈酸性或碱性,离子之间不反应的能大量共存;
④加入Mg能放出H2的溶液呈强酸性,离子之间不反应且和氢离子不反应的能大量共存;
⑤使石蕊变红的溶液呈酸性,离子之间不反应的能大量共存;
⑥中性溶液中,离子之间不反应的能大量共存.
解答 解:①pH=0的溶液呈酸性,C2O42-、MnO4-在酸性条件下发生氧化还原反应而不能大量共存,故错误;
②pH=11的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故正确;
③水电离的H+浓度为10-12mol•L-1的溶液呈酸性或碱性,酸性条件下,CO32-、SO32-不能大量共存,故错误;
④加入Mg能放出H2的溶液呈酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故正确;
⑤使石蕊变红的溶液呈酸性,酸性条件下,Fe2+和MnO4-、NO3-发生氧化还原反应而不能大量共存,故错误;
⑥中性溶液中Fe3+生成氢氧化铁而不能大量共存,故错误;
故选C.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,涉及复分解反应、氧化还原反应,易错选项是⑥,注意铁离子中性条件下生成沉淀,为易错点.

练习册系列答案
相关题目
13.同周期的A、B、C三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3CO4<H2BO4<HAO4,则下列判断正确的是( )
| A. | 原子半径 A>B>C | |
| B. | 阴离子的还原性按A、B、C的顺序由强到弱 | |
| C. | 非金属性 A>B>C | |
| D. | 气态氢化物的稳定性按A、B、C的顺序由弱到强 |
14.某溶液中加入氯化钡溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 可能不含CO32- | D. | 可能含有SO42-或Ag+ |
11.下列叙述正确的是( )
| A. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| B. | 检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色.该实验说明FeCl3与KI反应有一定的限度 | |
| D. | 铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
18.下列有关化学用语使用正确的是( )
| A. | H2O的电子式: | B. | 硫原子的原子结构示意图: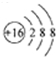 | ||
| C. | CO2的比例模型: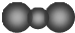 | D. | 基态氧原子的轨道表示式为: |
8.下列叙述正确的是( )
| A. | 化学是一门“中心的、实用的、创造性的”科学,在能源、资源的合理开发和安全应用方面有重要的作用 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 |
15.20℃时对0.2mol•L-1的HA溶液中,改变下列条件一定能使HA的电离平衡正向移动的是( )
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |
12.Na2O与Na2O2的相同点是( )
| A. | 氧元素化合价 | B. | 颜色状态 | C. | 阴、阳离子个数比 | D. | 为碱性氧化物 |