题目内容
6.在酸性条件下,KBrO3能把KI氧化成I2或KIO3,本身被还原成Br-或Br2,KIO3能氧化KI生成I2或氧化Br-成为Br2(本身均被还原为I2).请写出在稀H2SO4中KBrO3与KI发生反应的三个离子方程式:(1)①氧化剂和还原剂的物质的量之比为1:6,BrO3-+6I-+6H+=3I2+Br-+3H2O
②氧化剂和还原剂的物质的量之比为1:5,2BrO3-+10I-+12H+=5I2+Br2+6H2O
③氧化剂和还原剂的物质的量之比为6:5,6BrO3-+5I-+6H+=5IO3-+3Br2+3H2O
(2)现取1L 0.4mol/L KBrO3和4L 0.1mol/L KI与足量的稀硫酸混合,你认为发生上述三个反应的哪些反应(填编号)②③.
分析 (1)氧化还原反应中,氧化剂中元素的化合价降低,还原剂中,元素的化合价升高,根据电子守恒结合反应的产物书写化学方程式;
(2)1L 0.4mol/L KBrO3溶液中KBrO3的物质的量=0.4mol,若全部还原为Br2,可以获得电子为0.4×5=2mol,
4L 0.1mol/LKI溶液中KI物质的量0.4mol,若完全被氧化为KIO3,失去电子为0.4mol×6=2.4mol,若全部为氧化为I2,失去电子为0.4mol×1=0.4mol,
而0.4mol<2mol<2.4mol,故KI被氧化为KIO3、I2,KBrO3全部还原为Br2,据此回答.
解答 解:(1)①氧化剂和还原剂的物质的量之比为1:6,根据电子守恒,发生反应:BrO3-+6I-+6H+=3I2+Br-+3H2O,故答案为:BrO3-+6I-+6H+=3I2+Br-+3H2O;
②氧化剂和还原剂的物质的量之比为1:5,根据电子守恒,发生反应:2BrO3-+10I-+12H+=5I2+Br2+6H2O,故答案为:2BrO3-+10I-+12H+=5I2+Br2+6H2O;
③氧化剂和还原剂的物质的量之比为6:5,根据电子守恒,发生反应:6BrO3-+5I-+6H+=5IO3-+3Br2+3H2O,故答案为:6BrO3-+5I-+6H+=5IO3-+3Br2+3H2O;
(2)1L 0.4mol/L KBrO3溶液中KBrO3的物质的量=0.4mol,若全部还原为Br2,可以获得电子为0.4×5=2mol,
4L 0.1mol/LKI溶液中KI物质的量0.4mol,若完全被氧化为KIO3,失去电子为0.4mol×6=2.4mol,若全部为氧化为I2,失去电子为0.4mol×1=0.4mol,
而0.4mol<2mol<2.4mol,故KI被氧化为KIO3、I2,KBrO3全部还原为Br2,发生的反应有2BrO3-+10I-+12H+=5I2+Br2+6H2O、6BrO3-+5I-+6H+=5IO3-+3Br2+3H2O,
故选②③.
点评 本题考查氧化还原反应基本概念、有关计算及氧化性比较等,注意氧化还原反应得失电子数目相等,(2)为易错点、难点,注意利用假设法判断反应产物,难点中等.

 计算高手系列答案
计算高手系列答案| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 可能不含CO32- | D. | 可能含有SO42-或Ag+ |
| A. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| B. | 检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色.该实验说明FeCl3与KI反应有一定的限度 | |
| D. | 铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
| A. | H2O的电子式: | B. | 硫原子的原子结构示意图: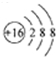 | ||
| C. | CO2的比例模型: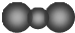 | D. | 基态氧原子的轨道表示式为: |
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |

 .
.