题目内容
20.天宫一号于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步.天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程.(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式:
2KNO3+S+3C═K2S+N2↑+3CO2↑.
①上述反应中的氧化剂是KNO3和S;若有0.5mol S参加反应,则转移的电子的物质的量为6mol;
②某化学兴趣小组进行了如下实验:实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清.变浑浊的物质是S(化学式表示);设计实验方案证明该澄清液中含有Cl-取少量溶液,加过量硝酸钡溶液,取上层清液,滴入硝酸酸化的硝酸银,若出现白色沉淀,证明有Cl-.
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂.高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式4NH4ClO4$\frac{\underline{\;碰撞\;}}{\;}$2N2↑+5O2↑+4HCl↑+6H2O;
(3)火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式N4H44++4OH-=N4↑+4H2O;
另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式2HN3$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+3N2↑.
分析 (1)①该反应中N元素化合价由+5价变为0价、S元素化合价由0价变为-2价、C元素化合价由0价变为+4价,得电子化合价降低的反应物是氧化剂;该反应中只有C是还原剂,根据方程式知,如果有0.5molS参加反应,则有1.5molC参加反应,根据C和转移电子之间关系式计算转移电子物质的量;
②酸性条件下,硝酸根离子具有强氧化性,能氧化Cu生成铜离子,自身被还原生成NO;
氯气具有强氧化性,能氧化硫化钾生成难溶性S单质;氯离子用硝酸酸化的硝酸银溶液检验,向溶液中加入少量硝酸酸化的硝酸银溶液,如果有白色沉淀生成说明有氯离子;
(2)高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分为氮气和氧气,另一种气体产物能使湿润的蓝色石蕊试纸变红,为氨气,根据原子守恒知还生成水蒸气;
(3)N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,阳离子结合氢氧根离子生成N4气体和水.
解答 解:(1)①该反应中N元素化合价由+5价变为0价、S元素化合价由0价变为-2价、C元素化合价由0价变为+4价,得电子化合价降低的反应物是氧化剂,所以KNO3和S是氧化剂;
该反应中只有C是还原剂,根据方程式知,如果有0.5molS参加反应,则有1.5molC参加反应,根据C和转移电子之间关系式得转移电子物质的量=1.5mol×(4-0)=6mol;
故答案为:KNO3和S;6;
②酸性条件下,硝酸根离子具有强氧化性,能氧化Cu生成铜离子,自身被还原生成NO,离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
氯气具有强氧化性,能氧化硫化钾生成难溶性S单质,所以溶液变浑浊;氯离子用硝酸酸化的硝酸银溶液检验,向溶液中加入少量硝酸酸化的硝酸银溶液,如果有白色沉淀生成说明有氯离子;
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;S;取少量溶液,加过量硝酸钡溶液,取上层清液,滴入硝酸酸化的硝酸银,若出现白色沉淀,证明有Cl-;
(2)高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分为氮气和氧气,另一种气体产物能使湿润的蓝色石蕊试纸变红,为氨气,根据原子守恒知还生成水蒸气,
反应方程式为:4NH4ClO4$\frac{\underline{\;碰撞\;}}{\;}$2N2↑+5O2↑+4HCl↑+6H2O,
故答案为:4NH4ClO4$\frac{\underline{\;碰撞\;}}{\;}$2N2↑+5O2↑+4HCl↑+6H2O;
(3)N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,阳离子结合氢氧根离子生成N4气体和水反应的离子方程式为N4H44++4OH-=N4↑+4H2O;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体为氨气,说明N4H4中含有NH4+,分析推断结构应为NH4N3,而与盐酸反应生成的产物之一具有极强烈的爆炸性,则钙化合物为HN3气体,依据原子守恒写出该产物爆炸的化学反应方程式为2HN3$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+3N2↑,
故答案为:N4H44++4OH-=N4↑+4H2O;2HN3$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+3N2↑.
点评 本题考查氧化还原反应有关计算、反应方程式的书写、离子检验等知识点,为高频考点,明确基本概念、各个物理量之间关系式、氯离子检验方法及实验现象是解本题关键,本题难点是判断反应中产物成分.

| A. | 0.9375d | B. | 0.9685d | C. | 1.0655d | D. | 0.9135d |
| A. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| B. | 检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色.该实验说明FeCl3与KI反应有一定的限度 | |
| D. | 铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
| A. | 化学是一门“中心的、实用的、创造性的”科学,在能源、资源的合理开发和安全应用方面有重要的作用 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 |
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |
| A. | 氧元素化合价 | B. | 颜色状态 | C. | 阴、阳离子个数比 | D. | 为碱性氧化物 |
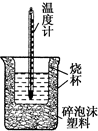 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,测得的中和热偏大(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“偏大”或“相等”或“偏小”),所求中和热相等(填“相等”或“不相等”),简述理由:因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会无影响.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族