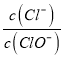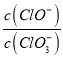题目内容
【题目】某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(Cr化合价+3价) 。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)molB.处理废水中Cr2O72- 的物质的量为![]() mol
mol
C.反应中发生转移的电子为3nx molD.在FeO·FeyCrxO3中3x=y
【答案】A
【解析】
A.由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1),又由FeOFeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A错误;
B.根据铬原子守恒,Cr为nxmol,故Cr2O72-的物质的量为![]() mol ,故B正确;
mol ,故B正确;
C.得到n molFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故反应中发生转移的电子为3nx mol,故C正确;
D.FeO·FeyCrxO3中,Cr正三价,由得失电子守恒知3x—y=0,即3x= y,故D正确;
故选A。

【题目】NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H= -180.5 kJmol1,2H2O(l)=2H2(g)+O2(g) △H=+571.6 kJmol1。
(1)则用H2催化还原NO消除污染的热化学方程式是_______________。
(2)苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10 (g)![]() C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
①当反应进行到20min时,该段时间内H2的平均反应速率是__________。
②该温度下,该反应的化学平衡常数是__________。
③若保持其他条件不变,用0.4molH2(g)和0.4molC8H8(g)合成C8H10(g),当有12kJ热量放出时,该反应中H2的转化率是______.此时,该合成反应是否达到了平衡状态?______(填“是”或“否”)。