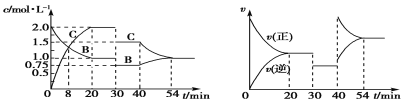
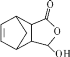
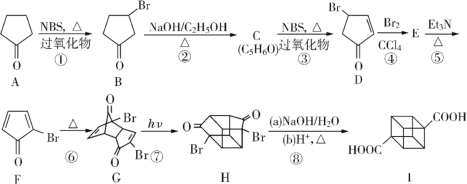题目内容
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O电子式为____________。
(2)下列能判断Cl和O两种元素非金属性强弱的是______(选填编号)。
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是________,氧化产物________。(填离子符号)
【答案】HClO(或次氯酸) ![]() ac Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律 2ClO2+2OH-=ClO2-+ClO3-+H2O ClO3-
ac Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律 2ClO2+2OH-=ClO2-+ClO3-+H2O ClO3-
【解析】
(1)酸酐与对应酸中Cl元素的化合价相同,Cl2O的结构为Cl-O-Cl;
(2)利用氢化物的稳定性、得电子能力等判断非金属性;
(3)结构相似的分子,相对分子质量越大,沸点越大;
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,为氧化还原反应,只有Cl元素的化合价变化。
(1)酸酐与对应酸中Cl元素的化合价相同,则Cl2O是为HClO的酸酐,Cl2O的结构为ClOCl,其电子式为![]() ;
;
(2)a.氧化氯的分子式中O为负价,则非金属性O大于Cl,故a正确;
b.与金属反应得电子的数目,不能比较非金属性,故b错误;
c.气态氢化物的稳定性强的为水,则非金属性O大于Cl,故c正确;
d.O元素不存在最高价氧化物对应水化物,故d错误;
故答案为:ac;
(3)上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律;
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2)和氯酸盐,为氧化还原反应,离子反应为2ClO2+2OH-=ClO2-+ClO3-+H2O,Cl元素失去电子被氧化,则氧化产物为ClO3。

【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。
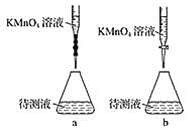
(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果____________(偏大、偏小或没有影响) 。