题目内容
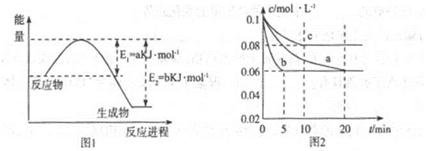
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
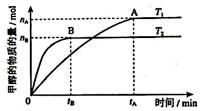
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= ;P和Cl2一步反应生成1mol PCl5的△H4 △H3 (填“大于”、“小于”或“等于”),原因是 。
(1)2P(s)+3Cl2(g)=2PCl3(g) △H =-612kJ/mol(2分)
(2)PCl5(g)=PCl3(g)+Cl2(g) △H =+93kJ/mol(2分) 25%(2分) 大于(2分)
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成(2分)
(4)-399kJ/mol (2分) 等于(1分),根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的(2分)
解析试题分析:(1)首先写出化学方程式并注明状态,然后根据图中的△H表示生成1mol产物的数据,可求出?H=2×-306kJ?mol?1=-612kJ?mol?1,进而写出热化学方程式。
(2)PCl5分解生成PCl3和Cl2为图中反应的逆反应,?H为相反数,为+93kJ?mol?1;加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,说明反应了0.2molPCl5,则分解率α1=0.2mol÷0.8mol×100%=25%;因为PCl5分解为吸热反应,温度升高,PCl5的分解率增大,故α2大于α1。
(3)温度过高,会促进PCl5的分解,不利于生成PCl5。
(4)根据图示可求出P和Cl2分两步反应生成1mol PCl5的△H3= —306kJ?mol?1—93kJ?mol?1=-399kJ?mol?1;根据盖斯定律,对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,所以?H3=?H4。
考点:本题考查热化学方程式的书写、盖斯定律、分解率的计算及温度对化学平衡的影响。

 阅读快车系列答案
阅读快车系列答案已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。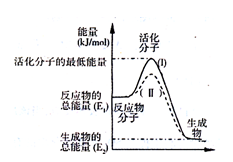
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
从表中数据分析,该实验的目的是 ;
表中显色时间t1= s;最终得出的结论是 。
 CH3OH(g) ΔH1
CH3OH(g) ΔH1
 cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 
 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
 2NH3(g)△H<0
2NH3(g)△H<0

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。

 2SO3(g)的平衡常数为 。
2SO3(g)的平衡常数为 。