��Ŀ����
�����仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺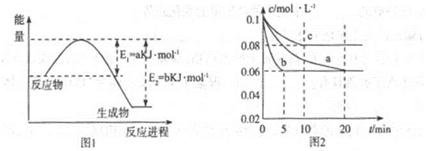
��1��ͼ1��1molNO2��1molCO��Ӧ����CO2��NO���������DZ仯ʾ��ͼ(a��b������0��)��֪:2CO(g)+2NO(g)=N2(g)+2CO2(g)��H=-ckJ��mol-1��c>0��
��д��CO��NO2��ԭ��N2ʱ���Ȼ�ѧ����ʽ____________��
��2��ͼ2��ʵ������������ͬ�������ܱ������кϳɰ�ʱ��N2��Ũ����ʱ��ı仯����(��a��b��c��ʾ������֪������������ʼ����Ũ�Ⱦ�Ϊ��c(N2)=0.1mol��L-1��c(H2)=0.3mol��L-1���ϳɰ��ķ�Ӧ��N2(g)+3H2(g) 2NH3(g)��H<0
2NH3(g)��H<0
�ټ�����a��ƽ��ʱH2��ת����Ϊ______��
����ͼ2��֪��b��c����һ��������a��ͬ����c�������ı������______��
��д���ж�b��a������ͬ������____________��
��3������ͼ2��c�����ºϳɰ����ݻ��̶�������֪��ѧƽ�ⳣ��K���¶�(T)�Ĺ�ϵ���±�:
����ȷ��K1����Դ�С��K1______4.1x106(��д��>����-����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ� ��______(�������ĸ����
A��������NH3��Ũ�ȱ��ֲ��� B��2v(N2)(����=v(H2)(�棩
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��4����NH4Cl��Һ�����Ե�ԭ����(�����ӷ�Ӧ����ʽ��ʾ )______��
��250Cʱ����pH=x��ˮ��pH=y������(��x+y=14,x>11)�������Ϻ�������Һ�и������ӵ�Ũ�ȹ�ϵ��ȷ����
A��[SO42-]>[NH4+]>[H+]>[OH-]
B��[NH4+]>[SO42-]>[OH-]>[H+]
C��[NH4+]+[H+]>[OH-]+[SO42-]
D��[NH4+]>[SO42-]>[H+]>[OH-]
(12��)
��1��4CO(g)+2NO2(g)=4CO2(g)+N2(g)��H=-(2b+c-2a)kJ��mol(2��)
��4CO(g)+2NO2(g)=4CO2(g)+N2(g)��H=(2a-2b-c)kJ��mol��
��2����40%(2��)
�������¶�(1��)����Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ�������b��a�������´ﵽƽ����N2��Ũ����ͬ�������������𰸣�(2��)��
��3��<(1��)��AC(2��)��
��4����NH+4+H2O=NH3��H2O+H+(2��)
��BC(2��)
���������������
��1�����������Ϣ���Եõ�����ʽNO2(g)+CO(g)=CO2(g)+NO(g)��H=-��b-a��kJ��mol����Ϣ�ʽ��2CO(g)+2NO(g)=N2(g)+2CO2(g)��H=-ckJ��mol-1��c>0�����ɢ١�2+�ڵ�CO��NO2��ԭ��N2ʱ���Ȼ�ѧ����ʽ��4CO(g)+2NO2(g)=4CO2(g)+N2(g)��H=-(2b+c-2a)kJ��mol
��2����ƽ��ʱ������Ũ��Ϊ0.06mol/L��ת������Ϊ0.04mol/L�����ݼ�����֮��H2ת������Ϊ0.12mol/L��H2��ת����Ϊ0.12mol/L��0.30mol/L��100%=40%���������¶Ⱥϳɰ��ķ�Ӧ��N2(g)+3H2(g) 2NH3(g)��H<0Ϊ���ȷ�Ӧ��������ת�����½��������˵���ƽ���ʱ�䣬�п��ܡ���Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ�������b��a�������´ﵽƽ��ʹN2��Ũ����ͬ��
2NH3(g)��H<0Ϊ���ȷ�Ӧ��������ת�����½��������˵���ƽ���ʱ�䣬�п��ܡ���Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ�������b��a�������´ﵽƽ��ʹN2��Ũ����ͬ��
��3���ٺϳɰ��ķ�Ӧ��N2(g)+3H2(g) 2NH3(g)��H<0Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K���С����ƽ��ʱ�������ʵ������䣬����A.������NH3��Ũ�ȱ��ֲ��䣬��ȷ��C.������ѹǿ���ֲ��䣬��ȷ��B.3v(N2)(����=v(H2)(�棩������D.�����Ǻ���������������������������䣬���������ܶȱ��ֲ��䣬����
2NH3(g)��H<0Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K���С����ƽ��ʱ�������ʵ������䣬����A.������NH3��Ũ�ȱ��ֲ��䣬��ȷ��C.������ѹǿ���ֲ��䣬��ȷ��B.3v(N2)(����=v(H2)(�棩������D.�����Ǻ���������������������������䣬���������ܶȱ��ֲ��䣬����
��4����NH4Cl��ˮ�⣺NH4++H2O=NH3��H2O+H+���ڣ���x+y=14����ˮ���������OH-����������ȫ�������H+��˵����ˮҪԶ�������ᣬ�������Ϻ���Һһ���ʼ���[H+]<[OH-]����ϵ���غ�ʽ��
[NH4+]+[H+]=[OH-]+2[SO42-]����֪BC��ȷ��
���㣺�����˹���ɡ���ѧƽ����������ƶ����������Լ��������Һ֪ʶ��

����(H2NCONH2)��һ�ַdz���Ҫ�ĸߵ����ʣ��ڹ�ũҵ���������ŷdz���Ҫ�ĵ�λ��
��1����ҵ�Ϻϳ����صķ�Ӧ���£�
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) ��H=-103��7 kJ��mol-1
H2O(l)+H2NCONH2(l) ��H=-103��7 kJ��mol-1
���д�ʩ��������������ص��������ʵ���
| A�����ø��� |
| B�����ø�ѹ |
| C��Ѱ�Ҹ���Ч�Ĵ��� |
| D����С��ϵ��CO2Ũ�� |
��һ����2NH3(l)+CO2(g)
 H2NCOONH4(���������)(l) ��H1
H2NCOONH4(���������)(l) ��H1�ڶ�����H2NCOONH4(l)
 H2O(l)+H2NCONH2(l) ��H2��
H2O(l)+H2NCONH2(l) ��H2��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0��5 L�ܱ�������Ͷ��4 mol����l mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯����ͼI��ʾ��

����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ� ����Ӧ�������ܷ�Ӧ���е� minʱ����ƽ�⡣
�ڵڶ�����Ӧ��ƽ�ⳣ��K���¶ȵı仯����ͼII��ʾ�����H2 0(�>�� ��<�� �� ��=��)
��3�����¶�70-95��ʱ����ҵβ���е�NO��NO2������������Һ���գ�����ת��ΪN2
��������NO��NO2���ߵ����ʵ�����Ӧ����ѧ����ʽΪ
����֪��N2(g)+O2(g)=2NO(g)����H=180��6 kJ��mol-1
N2(g)+3H2(g)=2NH3(g) ��H=-92��4 kJ��mol-1
2H2(g)+O2(g)=2H2O(g) ��H=-483��6 kJ��mol-1
��4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) ��H= kJ��mol-1
��4������ȼ�ϵ�ؽṹ����ͼIII��ʾ���乤��ʱ�����缫��Ӧʽ
�ɱ�ʾΪ ��
�״���һ�ֳ��õ�ȼ�ϣ���ҵ�Ͽ�����CO��H2��һ�������ºϳɼ״���
��1����֪CO��g����H2��g����CH3OH��1����ȼ���ȡ�H�ֱ�Ϊ��-283.0kJ��mol��-285.8 kJ/mol��-726.5kJ/mol����CO�ϳɼ״����Ȼ�ѧ����ʽΪ�� ��
��2���ں����ܱ�������CO��H2������Ӧ���ɼ״���������Ũ���ڲ�ͬ�����µı仯״����ͼ��ʾ����ʼʱ������Ũ�����ߺ�8���Ӻ�״���Ũ������δ������4���Ӻ�8���Ӹı��������ͬ���� 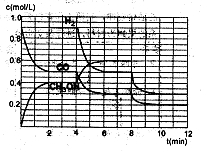
������˵����ȷ����
| A����ʼʱn��H2��Ϊ1��7mol |
| B����������ѹǿ�㶨ʱ��˵����Ӧ�ﵽƽ��״̬ |
| C��4����ʱ���ı�������������¶� |
| D��7����ʱ��v��CO��=v��CH3OH�� |
����3minʱ�÷�Ӧ��ƽ�ⳣ��K= ����������
����ͼ�л���8~12min֮��c��CH3OH������
��2��2009�꣬�й��ڼ״�ȼ�ϵ�ؼ����ϻ��ͻ�ƣ���װ���Ժ�����ؼ�����ʽ��ѣ���װ��ԭ����ͼ�ס�
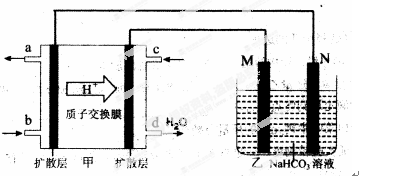
�ٸõ�صĸ�����ӦʽΪ�� ��
���ҳ���һ����Ʒ���桰�ۻ���װ�ã������ֱ�Ϊ����Ʒ��ʯī��
M�缫�IJ����� ��������Ʒ���桰�ۻ���ʱ�ķ�ӦʽΪ�� ��

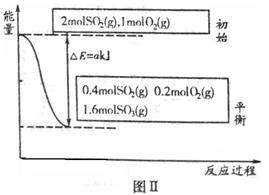
 2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��
2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ�� 



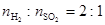 ����
���� 2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����
2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����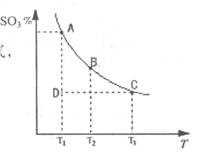
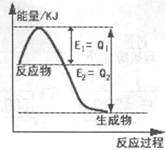
 W (s) + 2H2O (g)����H�� +66.0 kJ�� mol��1
W (s) + 2H2O (g)����H�� +66.0 kJ�� mol��1