��Ŀ����
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���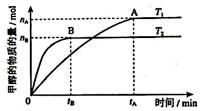
��ӦI�� CO(g)+2H2(g) CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ��H2
CH3OH(g)+ H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� (�I����)��
���������������������£������¶ȶԷ�ӦII��Ӱ�죬ʵ������ͼ��ʾ
��ͼ�������ж� ��H2 0 (���������=������)��
��ij�¶��£���2 mol CO2��6 mol H2����2L���ܱ������У�������ӦII���ﵽƽ����c(CO2)= 0��2 mol/L�� ���ʱ�����е�ѹǿΪԭ���� ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ��H =-1275��6 kJ/mol
�� 2CO (g)+ O2(g) = 2CO2(g) ��H =-566��0 kJ/mol
�� H2O(g) = H2O(l) ��H =-44��0 kJ/mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�
�ٸõ�ظ����ĵ缫��ӦΪ
�ڴ˵�����ļ״�1��6��ʱ����Ӧ�е���ת����ĿΪ
�����Դ�ȼ�ϵ��ΪǦ���س�磬��Ӧ��ͼ���Ҳ�缫�������ص� (��������)
��1�� �� I �� < �� 0��6 ��2��442��8 KJ ��3��CH3OH+8OH- -6e- = CO32- +6H2O0��3NA ����
���������������1��ԭ�Ӿ��þ��Ƿ�Ӧ���ԭ��ȫ��ת��Ϊ�����ѡ��ӦI�Ļ��Ϸ�Ӧ����ͼ��֪��T2>T1�������¶ȼ״������ʵ������٣�˵�������¶Ȼ�ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����ƶ������淴Ӧ���������ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ���ʡ�H2<0���۷�Ӧ��ʼʱC��CO2��="1mol/L," C(H2)=3mol/L���ڴﵽƽ����c(CO2)= 0��2 mol/L��CO2�ı�Ũ����0��8mol/L,����H2�ı�Ũ��Ϊ2��4mol/L�� H2ƽ��Ũ��Ϊ0��6mol/L�������ļ״���ˮ������Ũ�ȶ���0��8mol/L��ƽ��ʱ��Ũ����2��4mol/L,����ʼʱ��Ũ����4mol/L��������ʱ��ѹǿ�ǿ�ʼ��2��4mol/L��4mol/L=0��6������2����-��+�ۡ�4�ã�2CH3OH(l) + 2O2(g) =" 2CO" (g) + 4H2O(l) ��H =-1275��6 kJ/mol��H =-885��6 kJ/mol�����Բ���1molһ����̼��Һ̬ˮ�ų�������Ϊ442��8 KJ����3���״�ȼ�ϵ�صĸ�����ͨ��״��ĵ缫���缫��ӦΪCH3OH+8OH- -6e- = CO32- +6H2O��ÿĦ���ļ״���Ӧת�Ƶ���9Ħ�������ļ״�1��6��ʱ��n(CH3OH)=1��6g��32g/mol=0��05mol,����ת�Ƶ���0��3 NA�������Դ�ȼ�ϵ��ΪǦ���س�磬��Ӧ��ͼ���Ҳ�缫�������صĸ�����
���㣺����ȼ�ϵ�ء����ص����ڼ��缫��Ӧ������ת�Ƶ�֪ʶ��

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�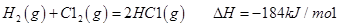
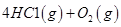
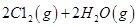

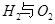 ��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________
��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________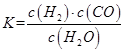
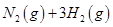
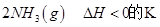 =0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ
=0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ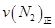 ____________
____________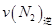 �������������������ȷ������
�������������������ȷ������
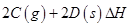 ���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
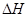 ___________0�������������
___________0������������� B��������ѹǿ���ֲ���
B��������ѹǿ���ֲ��� 2SO3��g�� ��H="-197" kj��mol����ʼʱ��10 L���ܱ������м���4��0 mol SO2��g����10��0 mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�197kJ�����������¶��µ�ƽ�ⳣ��K= �������¶�K�� �������С�䡱����
2SO3��g�� ��H="-197" kj��mol����ʼʱ��10 L���ܱ������м���4��0 mol SO2��g����10��0 mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�197kJ�����������¶��µ�ƽ�ⳣ��K= �������¶�K�� �������С�䡱����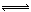 2SO3��g������ѧ��ȤС���ͬѧ̽����������������ʱ���ı�ijһ����ʱ��������Ӧ��Ӱ�죬������ʵ���������������й�ϵͼ�������ж�����ȷ���� ������ĸ����
2SO3��g������ѧ��ȤС���ͬѧ̽����������������ʱ���ı�ijһ����ʱ��������Ӧ��Ӱ�죬������ʵ���������������й�ϵͼ�������ж�����ȷ���� ������ĸ����
 2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش�
2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش� 2SO3(g) ��H����196.6 kJ��mol��1��Ӧ���̵������仯ʾ��ͼ��
2SO3(g) ��H����196.6 kJ��mol��1��Ӧ���̵������仯ʾ��ͼ��

 ������ã�ʹ��Ӧ������������ɣ�
������ã�ʹ��Ӧ������������ɣ� ��
�� �Ĵ���ʽ��ʾ����
�Ĵ���ʽ��ʾ����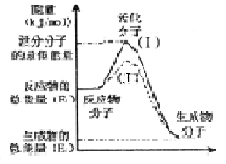
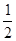 O2(g)�TH2O(g)����H=-241��5kJ/mol���÷�Ӧ�Ļ��Ϊ167�� 4kJ/mol�������淴Ӧ�Ļ��Ϊ________________��
O2(g)�TH2O(g)����H=-241��5kJ/mol���÷�Ӧ�Ļ��Ϊ167�� 4kJ/mol�������淴Ӧ�Ļ��Ϊ________________��