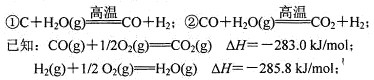题目内容
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下: 
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。
(3)NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线见图。
①由图可以看出,脱硝工艺流程应在 (填“有氧”或“无氧”)条件下进行。
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是 。
(4)NO2也可用尿素[CO(NH2)2]还原,写出尿素与NO2反应的化学方程式: 。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图11。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。若生成1molY,则理论上需要消耗标准状况下氧气的体积为 L。
(1)<(2)179.8(3)①有氧②温度升高,发生了副反应:4NH3+7O2=4NO2+6H2O。(若答温度升高,NOx和NH3反应的化学平衡向逆反应方向移动也可。)(4)4CO(NH2)2+6NO2=7N2+4CO2+8H2O(5)NO2+NO3--e-=N2O5 11.2
解析试题分析:(1)能自发进行的反应:ΔH-TΔS<0,该反应的ΔS<0,所以ΔH<0。(2)由盖斯定律得ΔH=(1807-1627.2)kJ?mol-1=+179.8 kJ?mol-1。(3)由图可知,无氧条件下NO转化率太低。温度升高,NO转化率下降,NO2产率增大,可能NH3与氧气生成了NO2。(4)尿素中C为+4价、N为-3价,尿素与NO2发生价态归中反应生成氮气,同时生成二氧化碳和水。(5)通二氧化氮的电极为负极、通氧气的电极为正极,石墨I电极上发生氧化反应,生成氧化物Y,考虑N最高价为+5价可知Y为N2O5,电极反应式为NO2+NO3--e-=N2O5。总反应为4NO2+O2=2N2O5,生成1molN2O5消耗氧气0.5mol。
考点: 化学反应进行的方向 盖斯定律 图像的分析 化学方程式的书写 电极反应式的书写 电化学计算

 作业辅导系列答案
作业辅导系列答案甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同): 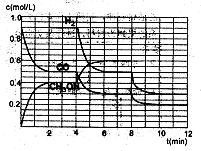
①下列说法正确的是
| A.起始时n(H2)为1.7mol |
| B.当容器内压强恒定时,说明反应达到平衡状态 |
| C.4分钟时,改变的条件是升高温度 |
| D.7分钟时,v(CO)=v(CH3OH) |
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。
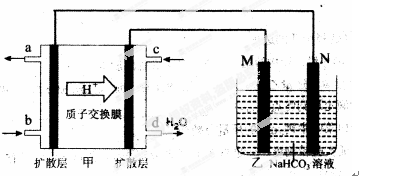
①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO
和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是 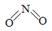 和
和 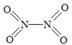 。
。
| 物质 | NO2 | N2O4 | |
| 化学键 | N=O | N—N | N=O |
| 键能(kJ/mol) | 466 | 167 | 438 |
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
①写出用CO还原NO生成N2的化学方程式 。
②在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
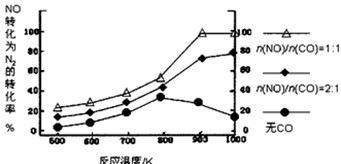
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 ;该反应的?H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO 发生反应的化学方程式为 。
 、
、 的代数式表示)。
的代数式表示)。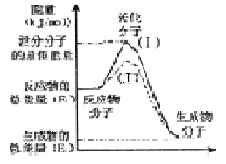
 O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。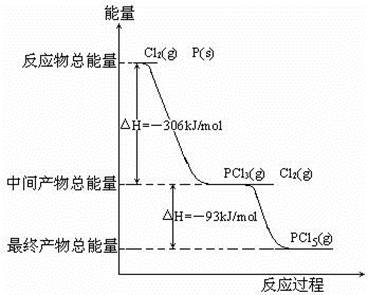

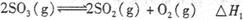


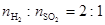 )。
)。 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):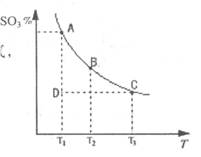

 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。