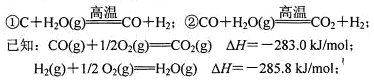题目内容
硫及其化合物在自然界中广泛存在,运用相关
原理回答下列问题:
(1)如图表示一定温度下,向体积为10L的密闭容器中充入1molO2和一定量的SO2后,SO2和SO3(g)的浓度随时间变化的情况。
①该温度下,从反应开始至平衡时氧气的平均反应速率是 ;
②该温度下,反应2SO2(g)+O2(g)  2SO3(g)的平衡常数为 。
2SO3(g)的平衡常数为 。
(2)以黄铜矿(主要成分CuFeS2)为原料,经焙烧、熔炼等使铁元素及其他有关杂质进入炉渣,将铜元素还原为铜。发生的主要反应为:
2Cu2S(s)+3O2(g) = 2Cu2O(s)+2SO2(g) △H ="-768.2" kJ·mol-1
2Cu2O(s)+ Cu2S (s) = 6Cu(s)+SO2(g) △H ="+116.0" kJ·mol-1
①“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,该反应的化学方程式为: 。
②在熔炼中,Cu2S与等物质的量的O2反应生成Cu的热化学方程式为: 。
(3)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
(14分,每空2分)
(1)①9×10-3mol?L?1?min?1 ②8.1×103 L?mol?1
(2)①2CuFeS2 + O2 Cu2S+ 2FeS+ SO2
Cu2S+ 2FeS+ SO2
②Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H ="-217.4" kJ·mol-1
(3)①2H2O+2e-=2OH-+H2 11.2x L
②2S2-+O2+2H2O=2S↓+4OH- ;
解析试题分析:
(1)①根据速率计算公式,可以求出速率为9×10-3mol?L?1?min?1; ② K=C2(SO3)/C2(SO2)*C(O2)= 8.1×103 L?mol?1;
(2)①根据题目信息“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,所以确定出反应物为CuFeS2 + O2产物应该是Cu2S+ 2FeS+ SO2 且要满足2:1,然后据原子守恒可求得。
且要满足2:1,然后据原子守恒可求得。
②Cu2S与等物质的量的O2反应生成Cu很显然这是个氧化还原反应,根据化合价有升有降和盖斯定律可以得出热化学方程式为Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H ="-217.4" kJ·mol-1。
(3)①由于溶液中的在阳极得电子的离子只能是阳离子且阳离子只有Na+和H+,所以只能有H+得电子,考虑到是碱性电解质溶液,所以反应式为2H2O+2e-=2OH-+H2;根据电子守恒,当有当反应转移xmol电子时,产生的气体物质的量为x/2mol,所以其体积为11.2x L。②由于S2-有强的还原性易被空气中氧气氧化,再考虑到硫化钠溶液呈碱性,所以其离子方程式为2S2-+O2+2H2O=2S↓+4OH- ;
考点:考查反应速率和平衡常数的计算,新情景下方程式的书写和电极反应方程式的书写等内容。

 阅读快车系列答案
阅读快车系列答案甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同): 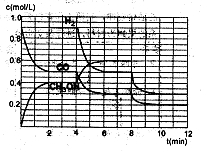
①下列说法正确的是
| A.起始时n(H2)为1.7mol |
| B.当容器内压强恒定时,说明反应达到平衡状态 |
| C.4分钟时,改变的条件是升高温度 |
| D.7分钟时,v(CO)=v(CH3OH) |
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。
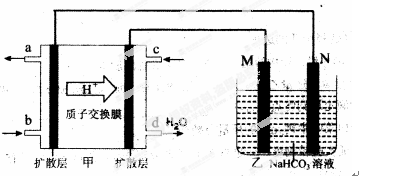
①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO
和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是 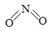 和
和  。
。
| 物质 | NO2 | N2O4 | |
| 化学键 | N=O | N—N | N=O |
| 键能(kJ/mol) | 466 | 167 | 438 |
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
①写出用CO还原NO生成N2的化学方程式 。
②在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。

为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 ;该反应的?H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO 发生反应的化学方程式为 。
mA(s)+nB(g)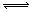 qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
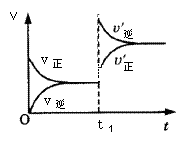
甲 乙
| A.n<q | B.n>q |
| C.正反应为放热反应 | D.X点比Y点反应速率快 |


 2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
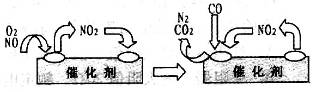 。
。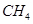 催化还原
催化还原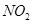 的方法也可以消除氮氧化物的污染。例如:
的方法也可以消除氮氧化物的污染。例如: W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1
W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。