题目内容
【题目】下表是周期表中的一部分,根据①﹣⑩在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ④ | ⑦ | ⑧ | ⑩ | ||||
3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 还原性最强的单质是 , 可用于制半导体材料的元素是;
(2)最高价氧化物的水化物酸性最强的是 , 呈两性的是 , 最高价氧化物的水化物碱性最强的是 , 电子式为;
(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式 .
【答案】
(1)Ne;F、O;Na;Si
(2)HClO4;Al(OH)3;NaOH;![]()
(3)Na
(4)PH3
(5)2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
(6)缓慢;Be+2HCl═BeCl2+H2↑
【解析】解:由元素在周期表中的位置可知,①为H,②为Na,③为Al,④为C,⑤为Si,⑥为P,⑦为O,⑧为F,⑨为Cl,⑩为Ne.
(1.)稀有气体Ne化学性质最不活泼;氧元素、氟元素没有正化合价;同周期自左而右金属性减弱,同主族自上而下金属性增强,Na的金属性最强,单质的还原性最强;可用于制半导体材料的元素是硅,所以答案是:Ne;F、O;Na;Si;
(2.)F元素没有最高价含氧酸,最高价氧化物的水化物酸性最强的是HClO4 , Al(OH)3是两性氢氧化物,上述元素中Na的金属性最强,故最高价氧化物的水化物碱性最强的是NaOH,电子式为 ![]() 所以答案是:HClO4;Al(OH)3;NaOH;
所以答案是:HClO4;Al(OH)3;NaOH; ![]() ;
;
(3.)同周期自左而右原子半径减小,一般电子层越多原子半径越大,原子半径最大的是Na,所以答案是:Na;
(4.)O、Cl、P中P的非金属性最弱,非金属性越强,对应氢化物越稳定,故PH3 稳定性最弱,所以答案是:PH3;
(5.)②元素最高价氧化物对应的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,所以答案是:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑;
(6.)Be的金属性比Li的弱,单质铍与酸反应比单质锂与酸反应更加缓慢,Be与盐酸发生置换反应生成BeCl2与H2 , 反应方程式为:Be+2HCl═BeCl2+H2↑,所以答案是:缓慢;Be+2HCl═BeCl2+H2↑.

 期末1卷素质教育评估卷系列答案
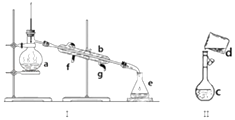
期末1卷素质教育评估卷系列答案【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%浓H2SO4 | Na2SO3固体 | 98%浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D